Электрический синапс
Электри́ческий си́напс (англ. electrical synapse) — место высокоспециализированных контактов (щелевых контактов) между нейронами, где происходит прямое перетекание электрических токов от одного нейрона к другому[1]. В щелевых контактах мембраны соседних клеток находятся на расстоянии около 3,8 нм, в то время как в химическом синапсе расстояние между двумя нейронами составляет от 20 до 40 нм[2]. У многих животных в нервной системе имеются как химические, так и электрические синапсы. По сравнению с химическими синапсами, электрические синапсы проводят нервные импульсы быстрее, однако, в отличие от химических синапсов, сигнал на постсинаптическом нейроне оказывается равным или меньше первоначального сигнала. Электрические синапсы активно используют животные, которым необходима способность развивать наиболее быстрый ответ, какой возможно, например, в случае защитных рефлексов. Как правило, электрические синапсы двунаправленны, то есть нервный импульс может проходить по ним в обоих направлениях[3].
Структура
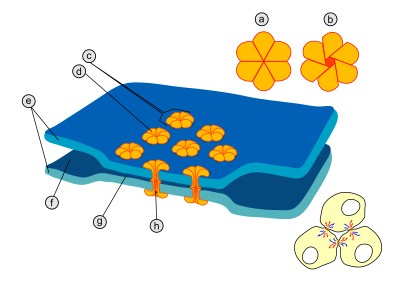
В области каждого щелевого контакта имеется множество особых каналов, пересекающих мембраны обеих клеток[4]. Диаметр таких каналов составляет от 1,2 до 2 нм[2][5], поэтому через них могут проходить из одной клетки в другую ионы и молекулы среднего размера, благодаря чему цитоплазмы двух соседних клеток оказываются соединёнными[2][6]. Поэтому когда мембранный потенциал одной из клеток меняется, из неё ионы могут переместиться в соседнюю клетку, деполяризуя её за счёт своего положительного заряда. Каналы щелевых контактов состоят из двух полуканалов, которые у позвоночных называются коннексонами (каждый полуканал принадлежит одной из клеток, соединённых синапсом)[2][5][7]. Каждый коннексон образован шестью белковыми субъединицами — коннексинами[англ.]. Коннексин имеет длину 7,5 нм и содержит четыре трансмембранных[англ.] участка. Коннексины в составе коннексона одинаковы или могут немного отличаться[5]. Частным случаем электрического синапса является аутапс[англ.] (англ. autapse), в образовании которого принимают участие аксон и дендрит одного и того же нейрона[8].
Функции

Простота устройства электрических синапсов позволяет им проводить сигнал очень быстро, однако они участвуют лишь в простых поведенческих реакциях, в отличие от более сложно устроенных химических синапсов. Поскольку для передачи сигнала через электрический синапс не нужно связывание рецептора с сигнальной молекулой-лигандом, при работе электрических синапсов не происходит задержки, которая у химических синапсов может составлять от 0,5 до 4 миллисекунд. Однако у млекопитающих различия в скоростях проведения сигнала электрическим и химическим синапсом не различаются так сильно, как у холоднокровных животных[5]. Благодаря высокой скорости проведения сигнала электрическим синапсам несколько соседних нейронов развивают потенциал действия практически одновременно[4][5][9]. Ответ постсинаптического нейрона имеет тот же знак, что и изменения в пресинаптическом нейроне. Так, деполяризация пресинаптической мембраны всегда вызовет деполяризацию постсинаптической мембраны, то же самое имеет место для гиперполяризации. Как правило, ответ постсинаптического нейрона меньше, чем амплитуда исходного сигнала; это обусловлено сопротивлением пре- и постсинаптической мембран. Электрические синапсы имеют сравнительно низкую утомляемость и очень устойчивы к изменениям внешней и внутренней среды[10]. Обычно сигнал может проходить через электрические синапсы в обоих направлениях, однако из этого правила есть исключения. Иногда в ответ на деполяризацию в мембране аксона открываются потенциалзависимые ионные каналы, которые не дают сигналу распространяться в обоих направлениях[2][9]. Имеются свидетельства своего рода «пластичности» электрических синапсов, то есть электрическая связь между двумя нейронами может ослабляться или усиливаться в зависимости от активности синапса[11] или при изменении внутриклеточной концентрации магния[12].
Распространение
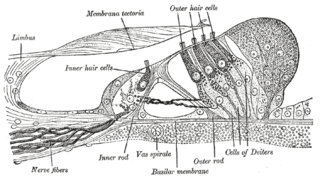
Электрические синапсы встречаются по всей центральной нервной системе. Они были детально изучены в неокортексе, гиппокампе, таламическом ретикулярном ядре[англ.], голубом пятне, нижнем оливковом ядре[англ.], мезенцефалическом ядре тройничного нерва[англ.], обонятельных луковицах, сетчатке и спинном мозге позвоночных. Электрические синапсы были обнаружены также в полосатых телах, мозжечке и супрахиазматическом ядре[13][14]. Как правило, электрические синапсы опосредуют очень быстрые поведенческие ответы, как, например, выпускание чернил морским зайцем Aplysia при опасности. Электрические синапсы были обнаружены и вне нервной системы. Электрические синапсы связывают рецепторные клетки[англ.], кардиомиоциты, гладкомышечные клетки, клетки печени, глиальные и эпителиальные клетки[1].
Электрические синапсы наиболее характерны для низкоорганизованных животных. В ходе эволюции доля электрических синапсов уменьшалась, и в ЦНС млекопитающих (в том числе человека) на долю электрических синапсов приходится около 1 % связей между нейронами[1].
Клиническое значение
Генетические дефекты коннексинов нередко являются причиной пороков сердца, так как электрические синапсы играют важнейшую роль в синхронизации электрической и сократительной активности сердца. Нарушения в работе коннексинов в шванновских клетках приводят к функциональной патологии аксонов, что лежит в основе болезни Шарко — Мари — Тута. При этом заболевании наблюдается прогрессивная двигательная и сенсорная нейропатия[англ.], кроме того, скорость проведения потенциала действия по аксонам снижена. Образование щелевых контактов между гладкомышечными клетками стенки матки находится под влиянием эстрогенов, которые стимулируют их образование в период беременности. Дефекты щелевых контактов в матке и снижение их числа нередко приводят к преждевременным родам[15].
История изучения
Впервые гипотеза о существовании электрических синапсов была выдвинута в начале XX века Камилло Гольджи и Йозефом Герлахом. Однако после открытия химических синапсов существование электрических синапсов считалось недостоверным, и до середины XX века главенствовало мнение, что передача потенциала действия между нейронами осуществляется исключительно посредством химических синапсов. Тем не менее, в 1959 году Дэвид Поттер и Эдвин Фершпан убедительно доказали существование электрических синапсов на примере гигантского аксона и аксоном моторного нейрона в брюшной нервной цепочке рака[1].
Примечания
- ↑ 1 2 3 4 Балезина, Гайдуков, Сергеев, 2017, с. 140.
- ↑ 1 2 3 4 5 Hormuzdi S. G., Filippov M. A., Mitropoulou G., Monyer H., Bruzzone R. Electrical synapses: a dynamic signaling system that shapes the activity of neuronal networks. (англ.) // Biochimica Et Biophysica Acta. — 2004. — 23 March (vol. 1662, no. 1-2). — P. 113—137. — doi:10.1016/j.bbamem.2003.10.023. — PMID 15033583.
- ↑ Purves, Dale; George J. Augustine; David Fitzpatrick; William C. Hall; Anthony-Samuel LaMantia; James O. McNamara; Leonard E. White. Neuroscience (неопр.). — 4th. — Sinauer Associates[англ.], 2008. — С. 85—88. — ISBN 978-0-87893-697-7.
- ↑ 1 2 Gibson J. R., Beierlein M., Connors B. W. Functional properties of electrical synapses between inhibitory interneurons of neocortical layer 4. (англ.) // Journal Of Neurophysiology. — 2005. — January (vol. 93, no. 1). — P. 467—480. — doi:10.1152/jn.00520.2004. — PMID 15317837.
- ↑ 1 2 3 4 5 Bennett M. V., Zukin R. S. Electrical coupling and neuronal synchronization in the Mammalian brain // Neuron. — 2004. — Vol. 41, № 4. — P. 495—511. — doi:10.1016/S0896-6273(04)00043-1. — PMID 14980200.
- ↑ Kandel et al., 2000, p. 178–180.
- ↑ Kandel et al., 2000, p. 178.
- ↑ Seung H. Sebastian, Lee Daniel D., Reis Ben Y., Tank David W. [1] (англ.) // Journal of Computational Neuroscience. — 2000. — Vol. 9, no. 2. — P. 171—185. — ISSN 0929-5313. — doi:10.1023/A:1008971908649.
- ↑ 1 2 Kandel et al., 2000, p. 180.
- ↑ Балезина, Гайдуков, Сергеев, 2017, с. 146.
- ↑ Haas J. S., Zavala B., Landisman C. E. Activity-dependent long-term depression of electrical synapses. (англ.) // Science (New York, N.Y.). — 2011. — 21 October (vol. 334, no. 6054). — P. 389—393. — doi:10.1126/science.1207502. — PMID 22021860.
- ↑ Palacios-Prado N., Hoge G., Marandykina A., Rimkute L., Chapuis S., Paulauskas N., Skeberdis V. A., O'Brien J., Pereda A. E., Bennett M. V. L., Bukauskas F. F. Intracellular Magnesium-Dependent Modulation of Gap Junction Channels Formed by Neuronal Connexin36 (англ.) // Journal of Neuroscience. — 2013. — 13 March (vol. 33, no. 11). — P. 4741—4753. — ISSN 0270-6474. — doi:10.1523/JNEUROSCI.2825-12.2013.
- ↑ Eugenin E. A., Basilio D., Sáez J. C., Orellana J. A., Raine C. S., Bukauskas F., Bennett M. V., Berman J. W. The role of gap junction channels during physiologic and pathologic conditions of the human central nervous system. (англ.) // Journal Of Neuroimmune Pharmacology : The Official Journal Of The Society On NeuroImmune Pharmacology. — 2012. — September (vol. 7, no. 3). — P. 499—518. — doi:10.1007/s11481-012-9352-5. — PMID 22438035.
- ↑ Pereda A. E., Curti S., Hoge G., Cachope R., Flores C. E., Rash J. E. Gap junction-mediated electrical transmission: regulatory mechanisms and plasticity. (англ.) // Biochimica Et Biophysica Acta. — 2013. — January (vol. 1828, no. 1). — P. 134—146. — doi:10.1016/j.bbamem.2012.05.026. — PMID 22659675.
- ↑ Балезина, Гайдуков, Сергеев, 2017, с. 147—148.
Литература
- Балезина О. П., Гайдуков А. Е., Сергеев И. Ю. Физиология: биопотенциалы и электрическая активность клеток. — М.: Юрайт, 2017. — 165 с. — ISBN 978-5-534-04264-1.
- Kandel, ER; Schwartz, JH; Jessell, T. M. Principles of Neural Science (неопр.). — 4th. — New York: McGraw-Hill Education, 2000. — ISBN 0-8385-7701-6.
- Andrew L. Harris and Darren Locke. Connexins, a guide (неопр.). — New York: Springer, 2009. — С. 574. — ISBN 978-1-934115-46-6.
- Hestrin S. Neuroscience. The strength of electrical synapses. (англ.) // Science (New York, N.Y.). — 2011. — 21 October (vol. 334, no. 6054). — P. 315—316. — doi:10.1126/science.1213894. — PMID 22021844.