pH-метр — прибор для измерения водородного показателя, характеризующего активность ионов водорода в растворах, воде, пищевой продукции и сырье, объектах окружающей среды и производственных системах непрерывного контроля технологических процессов, в том числе в агрессивных средах. В частности, pH-метр применяется для аппаратного мониторинга pH растворов разделения урана и плутония, где требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.

Физи́ческая хи́мия — раздел химии, наука об общих законах строения, структуры и превращения химических веществ. Исследует химические явления с помощью теоретических и экспериментальных методов физики. Наиболее обширный раздел химии.
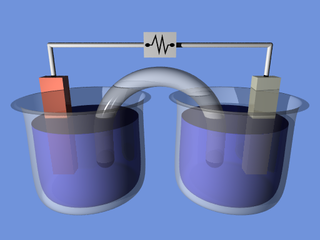
Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается.
Адсорбция — самопроизвольный процесс увеличения концентрации растворённого вещества у поверхности раздела двух фаз вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция.

Электродви́жущая си́ла (ЭДС) — скалярная физическая величина, характеризующая работу сторонних сил в квазистационарных цепях постоянного или переменного тока. В замкнутом контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль всего контура.
Метод локальной фиксации потенциала, patch-clamp — электрофизиологическая методика для изучения свойств ионных каналов, состоящая в том, что фрагмент клеточной мембраны изолируется с помощью специальной микропипетки. Эта методика даёт возможность экспериментатору контролировать разность потенциалов между сторонами мембраны, а также помещать её в среду с определённым химическим составом. В этих хорошо контролируемых условиях измеряют ионные токи, проходящие через мембрану, что, в конечном итоге, позволяет делать выводы о том, как ионные каналы реагируют на электрическое и химическое воздействие. Метод настолько чувствителен, что позволяет наблюдать поведение и химические превращения единичных молекул, взаимодействующих с мембраной. Разработаны экспериментальные протоколы, позволяющие измерять характеристики ионных каналов оптимальным образом. Немецкие исследователи Эрвин Неер и Берт Сакман, разработавшие эту методику, получили Нобелевскую премию в 1991 году.

Точка эквивалентности в титриметрическом анализе — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов.
Электрохимический ряд активности металлов (ряд напряжений, ряд (вытеснения) Бекетова, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов E0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Биопотенциал — энергетическая характеристика взаимодействия зарядов, находящихся в исследуемой живой ткани, например, в различных областях мозга, в клетках и других структурах.
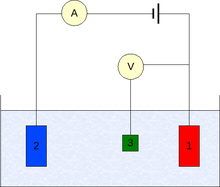
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью, на которую подаётся газообразный водород с давлением в 1 атм. и погружённую в водный раствор, содержащий ионы водорода с активностью равной 1. Потенциал стандартного водородного электрода при стандартных условиях принят равным 0.
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода являются: Pt/Fe3+, Fe2+.

Полярография — электрохимический метод качественного и количественного анализа и изучения кинетики химических процессов, предложенный в 1922 году чешским химиком Я. Гейровским. За разработку этого метода ему была присуждена в 1959 году Нобелевской премия по химии.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Хлоридсере́бряный электро́д (ХСЭ) благодаря стабильности потенциала и простоте конструкции является одним из наиболее часто употребляемых в лабораторной практике электродов сравнения.
Стеклянные электроды — тип ионоселективных электродов, сделанных из легированных стеклянных мембран, которые чувствительны к специфическим ионам, используемые для определения концентрации ионов в растворе. Важная часть приборов химического анализа и физико-химических исследований. В современной практике широко применяются мембранные ионоселективные электроды, являющиеся частью гальванического элемента. Электрический потенциал электродной системы в растворе чувствителен к изменению содержания определённого вида ионов, что выражается и в зависимости электродвижущей силы (ЭДС) гальванического элемента от концентрации этих ионов.
Двойно́й электри́ческий слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности твёрдого тела в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе раздела фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Окисли́тельно-восстанови́тельный элеме́нт — это гальванический элемент, состоящий из двух инертных электродов, опущенных в растворы солей с определенным окислительно-восстановительным потенциалом. Для этого элемента характерно то, что катионы и анионы, изменяя свой заряд, не выделяются на электродах и не появляются в растворе путём перехода вещества из электрода в раствор.
Хингидроновый электро́д используется для измерения рН в интервале от 0 до 6; в буферных растворах в отсутствие сильных окислителей в интервале от 0 до 8,5. Схематически записывается как: Pt(тв.)гладкая|хингидрон насыщенный, исследуемый расствор Электродная реакция:
С6Н4(ОН)2 → С6Н4О2 + 2Н+ + 2е

Экзергонические реакции, также самопроизвольные реакции — согласно второму началу термодинамики это химические реакции, которые протекают без притока энергии извне. Величина свободной энергии таких реакций всегда отрицательна, т.е. ΔG° < 0. Большинство химических реакций, которые протекают в окружающей среде — экзергонические, вследствие этого они являются термодинамически выгодными, в отличие от эндергонических. Примером экзергонических реакций являются процессы электролитической диссоциации, окисления и горения, сорбционные процессы, фотохимические процессы (фотодиссоциация), в живых организмах это процессы катаболизма — гликолиз, липолиз, протеолиз, окисление жирных кислот и многие другие.
Перенапряже́ние в электрохимии — отклонение электродного потенциала от его равновесного термодинамического значения при поляризации электрода внешним током. При заметном удалении от равновесия перенапряжение и плотность поляризующего тока обычно связаны соотношением h = а + b lg i, где а и b — эмпирические постоянные. Перенапряжение зависит от температуры, природы электродного материала и состава раствора. Перенапряжение необходимо для ускорения нужной электродной реакции. Если скорость электродной реакции в целом определяется скоростью собственно электрохимической стадии, связанной с переносом заряда, то перенапряжение усиливает электрическое поле, действующее на разряжающиеся частицы, благодаря чему снижается энергия активации разряда. Поскольку электрическое поле в значительной степени обусловлено строением двойного электрического слоя, перенапряжение оказывается зависящим от концентрации постороннего электролита и адсорбирующихся веществ, влияющих на распределение потенциала в двойном слое. На повышении перенапряжения основано действие многих ингибиторов коррозии металлов, что является одной из положительных сторон перенапряжения. В то же время перенапряжение в промышленном электролизе, неизбежно связанное с дополнительным расходом энергии, приводит к увеличению себестоимости продукции.