Эндотелиальная липаза
| Эндотелиальная липаза | |
|---|---|
| Идентификаторы | |
| Шифр КФ | 3.1.1.3 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
Эндотелиальная липаза (LIPG) — форма липазы, секретируемая эндотелиальными клетками сосудов в тканях с высокой скоростью метаболизма и васкуляризации, таких как печень, легкие, почки и щитовидная железа[1]. Фермент LIPG является жизненно важным компонентом многих биологических процессов. Эти процессы включают метаболизм липопротеинов, экспрессию цитокинов и состав липидов в клетках[1]. В отличие от липаз, которые гидролизуют триглицериды, эндотелиальная липаза в первую очередь гидролизует фосфолипиды[1]. Благодаря специфичности гидролиза эндотелиальная липаза участвует во многих жизненно важных системах организма. В противоположность полезной роли, которую играет LIPG в организме, считается, что эндотелиальная липаза играет потенциальную роль в развитии рака и воспаления[1]. Знания, полученные in vitro и in vivo, предполагают связь с этими условиями, но знаний о взаимодействии с людьми не хватает из-за недавнего открытия эндотелиальной липазы[2]. Эндотелиальная липаза была впервые охарактеризована в 1999 году[3] Две независимые исследовательские группы, которые примечательны этим открытием, клонировали ген эндотелиальной липазы и идентифицировали новую липазу, секретируемую из эндотелиальных клеток[2]. Возможность борьбы с атеросклерозом за счет уменьшения закупорки бляшек и потенциальной способности повышать уровень липопротеинов высокой плотности (ЛПВП) получила признание эндотелиальной липазы[4].
Открытие

В 1999 г. идентификация эндотелиальной липазы была независимо обнаружена двумя исследовательскими группами[2].
Первая группа в Рон-Пуленк Рорер клонировала и охарактеризовала нового члена семейства триацилглиеролов (ТГ). Когда эта новая эндотелиальная липаза была чрезмерно экспрессирована у мышей, концентрации холестерина ЛПВП и аполипопротеина A-I в плазме снижались[3].
Вторая группа из Стэнфордского университета независимо клонировала ту же самую эндотелиальную липазу из эндотелиальных клеток пупочной вены человека, эндотелиальных клеток коронарных артерий человека и желточных мешков, подобных эндотелию грызунов[5]. Для выделения генов использовали супрессивную субтрактивную гибридизацию[5]. Затем гены сравнивали и выравнивали. Два фрагмента кДНК экспрессировали ген липазы и эндотелиальные свойства[5]. Нозерн-блот-анализ задокументировал образцы[5]. Предполагаемая связь с метаболизмом и сосудистыми заболеваниями была приписана тканевой селективной экспрессии в эндотелиальных клетках[5].
Структура
Эндотелиальная липаза — это белок, относящийся к категории триглицеридных липаз[1]. Этот белок кодируется геном LIPG[1]. Эндотелиальная липаза секретируется эндотелиальными клетками сосудов и является единственной липазой на сегодняшний день[3]. Первичная секреция — это белок 55 кДа, который секретируется белком 68 кДа после посттрансляционного гликозилирования[1]. LIPG функционирует, поскольку он связывается с протеогликанами[1]. LIPG также может дополнительно расщепляться[1]. Дополнительное расщепление привело бы к неактивности N-конца белка 40 кДа, 40 кДа и С-конца 28 кДа[1]. LIPG обладает способностью образовывать димер белка перед секрецией, что вызывает появление димеризации[1]. Реакция присоединения того же соединения и молекул повышает устойчивость к расщеплению, и ограниченная активность сохраняется[1].

Биологическая функция
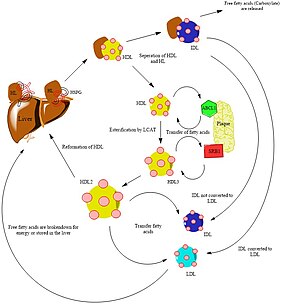
Метаболизм
Участком ферментативной активности эндотелиальной липазы является поверхность эндотелиальных клеток. LIPG регулирует метаболизм липопротеинов посредством гидролиза фосфолипдов ЛПВП[4]. Этот липопротеин высокой плотности является амфипатическим липидом, что означает, что липид состоит как из гидрофобного, так и из гидрофильного компонентов[6]. Холестерин имеет четырёхкольцевую структуру и представляет собой углеводород на основе изопреноидов[6]. Хотя холестерину не хватает головной фосфатной группы, гидроксильный компонент холестерина взаимодействует с водой, что делает холестерин амфипатическим[6]. Холестерин ЛПВП приносит огромную пользу организму и жизненно важен для поддержания текучести естественных мембран[6]. Холестерин ЛПВП необходимо поддерживать на определённом уровне, чтобы обеспечить нормальный рост и размножение клеток. Способность ЛПВП абсорбировать холестерин и транспортировать его в печень способствует удалению холестерина из организма[7]. Напротив, холестерин липопротеинов низкой плотности (ЛПНП) работает противоположно. Холестерин ЛПНП не выводит холестерин из организма, а, скорее, служит основой для накопления холестерина[7]. Необходимо поддерживать низкий уровень ЛПНП в организме, чтобы избежать накопления холестерина в артериях. Когда ЛПВП гидролизуются, скорость оборота ЛПВП увеличивается, а уровень холестерина в плазме снижается[4]. Этот гидролиз позволяет ускорить или продолжить выведение холестерина из организма, чтобы избежать его накопления. После гидролиза ЛПВП происходит поглощение предшественников липидов свободных жирных кислот[1]. Эти липиды затем используются в катаболизме других фосфолипидов[1]. Таким образом, эндотелиальная липаза считается ключевым компонентом метаболизма за счет гидролиза липопротеинов высокой плотности.
Биология сосудов
Эндотелиальная липаза связана с потенциальным лечением и улучшением течения атеросклероза. Атеросклероз — это сосудистое заболевание, которое вызывается накоплением артериальных бляшек[8]. Холестерин, жир, кальций и другие компоненты способствуют образованию бляшек в крови[8]. Бляшки вредны для сосудов, потому что они сужают и укрепляет артерии, вызывая недостаток насыщенного кислородом кровотока[8]. Повышение уровня ЛПВП служит лечением атеросклероза. Гидролиз ЛПВП приводит к транспортировке холестерина в печень[7]. Система фильтрации печени помогает вывести холестерин из организма. Следовательно, уровень холестерина в плазме снизится. Таким образом, синтез эндотелиальной липазы ЛПВП может предоставить адекватную возможность для повышения уровня ЛПВП. Данные показывают, что ингибирование эндотелиальной липазы должно повышать уровень ЛПВП в плазме, в первую очередь у пациентов с низким уровнем ЛПВП-С[4]. Повышенный риск атеросклероза связан с низким уровнем ЛПВП[4]. Хотя функциональную корреляцию можно провести, клинических данных, подтверждающих предполагаемые потенциальные преимущества в патофизиологии сосудов, мало.
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 "The role of endothelial lipase in lipid metabolism, inflammation, and cancer". Histology and Histopathology. 33 (1): 1—10. January 2018. doi:10.14670/HH-11-905. PMID 28540715.
- ↑ 1 2 3 "Endothelial lipase: its role in cardiovascular disease". The Canadian Journal of Cardiology. 22 Suppl B (Suppl B): 31B—34B. February 2006. doi:10.1016/S0828-282X(06)70984-9. PMID 16498510.
- ↑ 1 2 3 "A novel endothelial-derived lipase that modulates HDL metabolism". Nature Genetics. 21 (4): 424—8. April 1999. doi:10.1038/7766. PMID 10192396.
- ↑ 1 2 3 4 5 "A novel fluorogenic substrate for the measurement of endothelial lipase activity". Journal of Lipid Research. 52 (2): 374—82. February 2011. doi:10.1194/jlr.D007971. PMID 21062953.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 3 4 5 "Cloning of a unique lipase from endothelial cells extends the lipase gene family". The Journal of Biological Chemistry. 274 (20): 14170—5. May 1999. doi:10.1074/jbc.274.20.14170. PMID 10318835.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 3 4 Harvey F. Lodish. Molecular cell biology. — Eighth edition. — New York, 2016. — xl, 1170, G-28, I-36 pages с. — ISBN 978-1-4641-8339-3, 1-4641-8339-2, 978-1-4641-8744-5, 1-4641-8744-4.
- ↑ 1 2 3 CDC. LDL and HDL Cholesterol: "Bad" and "Good" Cholesterol (амер. англ.). Centers for Disease Control and Prevention (31 октября 2017). Дата обращения: 11 апреля 2019. Архивировано 12 сентября 2017 года.
- ↑ 1 2 3 Atherosclerosis | National Heart, Lung, and Blood Institute (NHLBI). www.nhlbi.nih.gov. Дата обращения: 11 апреля 2019. Архивировано 5 октября 2017 года.











