Эпигенетика
Эпигене́тика (др.-греч. ἐπι- — приставка, обозначающая пребывание на чём-либо или помещение на что-либо) — раздел генетики. Эпигенетика изучает наследуемые изменения активности генов во время роста и деления клеток (Эпигенетическое наследование) — изменения синтеза белков, вызванных механизмами, не изменяющими последовательность нуклеотидов в ДНК. Эпигенетические изменения сохраняются в ряде митотических делений соматических клеток, а также могут передаваться следующим поколениям. Регуляторы синтеза белка (активности генетических последовательностей) — метилирование и деметилирование ДНК, ацетилирование и деацетилирование гистонов, фосфорилирование и дефосфорилирование транскрипционных факторов и другие внутриклеточные механизмы[1].
Эпигеномом называется множество молекулярных меток, регулирующих активность генов, но не изменяющих первичную структуру ДНК[2].
В рамках эпигенетики исследуются такие процессы как: парамутация, генетический букмаркинг, геномный импринтинг, инактивация X-хромосомы, эффект положения, материнские эффекты, репрограммирование, а также другие механизмы регуляции экспрессии генов. В 2011 году было показано, что метилирование мРНК также играет роль в предрасположенности к диабету, что дало начало новой отрасли — РНК-эпигенетике[3].
В эпигенетических исследованиях используется широкий спектр методов молекулярной биологии, в том числе — иммунопреципитация хроматина (различные модификации ChIP-on-chip и ChIP-Seq), гибридизация in situ, чувствительные к метилированию рестриктазы, идентификации ДНК-аденин-метилтрансферазы (DamID), бисульфитное секвенирование. Кроме того, всё большую роль играет использование методов биоинформатики (компьютерная эпигенетика).
Примеры
Одним из примеров эпигенетических изменений у эукариот является процесс клеточной дифференцировки. Во время морфогенеза плюрипотентные стволовые клетки формируют различные полипотентные клеточные линии эмбриона, которые в свою очередь дают начало полностью дифференцированным клеткам. Другими словами, одна оплодотворённая яйцеклетка — зигота — даёт начало различным типам клеток: нейронам, мышечным клеткам, эпителиям, сосудам. При этом в ряду последовательных делений клеток происходит активация одних генов, а также ингибирование других при помощи эпигенетических механизмов[4].
Второй пример может быть продемонстрирован на полёвках. Осенью, перед похолоданием, они рождаются с более длинной и густой шерстью, чем весной, хотя внутриутробное развитие «весенних» и «осенних» мышей происходит на фоне практически одинаковых условий (температуры, длины светового дня, влажности и т. д.). Исследования показали, что сигналом, запускающим эпигенетические изменения, приводящие к увеличению длины шерсти, является изменение градиента концентрации мелатонина в крови (весной он снижается, а осенью — повышается). Таким образом, эпигенетические адаптивные изменения (увеличение длины шерсти) индуцируются ещё до наступления холодов, адаптация к которым выгодна для организма.
Эпигенетика играет большую роль в увеличении роста заболеваемостью аллергией, как и состав различных микробиомов — полости носа, кишечника и кожи[5].
Происхождение термина
Термин «эпигенетика» (как и «эпигенетический ландшафт») был предложен, как производное от слов «генетика» и аристотелевского слова «эпигенез». Автором гипотезы об «эпигенетических изменениях хромосом» является русский биолог Николай Константинович Кольцов[a][6][7][8], подкрепивший её своей ранней гипотезой о метилировании генома (1915)[9]. Экспериментально явление моделировал ученик Кольцова И. А. Рапопорт (1941)[b]. Популяризировал термин «эпигенетика» английский биолог Конрад Уоддингтон[c][2]. Кроме того психолог Эрик Эриксон использовал термин «эпигенетика» в своей теории психосоциального развития, однако, его определение не имеет прямой связи с биологической терминологией[10].
Определения
В 1930-е и 1940-е годы, когда этот термин вошел в научный обиход[8], физическая природа генов не была до конца известна, поэтому он использовал его в качестве концептуальной модели того, как гены могут взаимодействовать со своим окружением при формировании фенотипа.
Робин Холлидэй (Robin Holliday) определил эпигенетику как «изучение механизмов временного и пространственного контроля активности генов в процессе развития организмов»[11]. Таким образом, термин «эпигенетика» может быть использован, чтобы описать любые внутренние факторы, которые влияют на развитие организма, за исключением самой последовательности ДНК.
Современное использование этого слова в научном дискурсе является более узким. Греческий префикс epi- в слове, подразумевает факторы, которые влияют «поверх» или «в дополнение к» генетическим, а значит эпигенетические факторы воздействуют вдобавок или помимо традиционных генетических факторов наследственности.
Наиболее часто использующееся в настоящее время определение эпигенетики было введено А. Риггсом (Arthur D. Riggs) в 1990-х годах и формулируется как «изучение митотически и/или мейотически наследуемых изменений в функции генов, которые не могут быть объяснены изменениями в последовательности ДНК»[12].
Сходство со словом «генетика» породило много аналогий в использовании термина. «Эпигеном» является аналогом термина «геном» и определяет общее эпигенетическое состояние клетки. Метафора «генетический код» была также адаптирована, а термин «эпигенетический код» используется, чтобы описать набор эпигенетических особенностей, которые создают разнообразные фенотипы в различных клетках. Широко используется термин «эпимутация», которым обозначают вызванное спорадическими факторами изменение нормального эпигенома, передающееся в ряде клеточных поколений.
Молекулярные основы эпигенетики
Молекулярная основа эпигенетики сложна, причём она не затрагивает первичную структуру ДНК, а изменяет активность определённых генов[13][2]. Это объясняет, почему в дифференцированных клетках многоклеточного организма экспрессируются только гены, необходимые для их специфической деятельности. Особенностью эпигенетических изменений является то, что они сохраняются при клеточном делении. Известно, что большинство эпигенетических изменений проявляется только в пределах жизни одного организма. В то же время, если изменение в ДНК произошло в сперматозоиде или яйцеклетке, то некоторые эпигенетические проявления могут передаваться от одного поколения к другому[14].
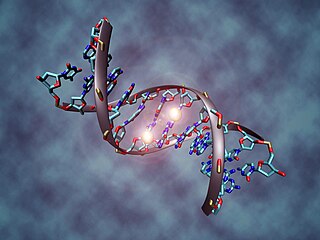
Метилирование ДНК
Наиболее хорошо изученным к настоящему времени эпигенетическим механизмом является метилирование цитозиновых оснований ДНК. Начало интенсивным исследованиям роли метилирования в регуляции генетической экспрессии, в том числе при старении, было положено ещё в 70-е годы XX века пионерскими работами Б. Ф. Ванюшина и Г. Д. Бердышева с соавторами. Процесс метилирования ДНК заключается в присоединении метильной группы к цитозину в составе CpG-динуклеотида в позиции C5 цитозинового кольца. Метилирование ДНК, в основном, присуще эукариотам. У человека метилировано около 1 % геномной ДНК. За процесс метилирования ДНК отвечают три фермента, называемые ДНК-метилтрансферазами 1, 3a и 3b (DNMT1, DNMT3a и DNMT3b). Предполагают, что DNMT3a и DNMT3b — это de novo метилтрансферазы, которые формируют профиль метилирования ДНК на ранних стадиях развития, а DNMT1 поддерживает метилирование ДНК на более поздних этапах жизни организма. Фермент DNMT1 имеет высокое сродство с 5-метилцитозином. Когда DNMT1 находит «полуметилированный сайт» (сайт, в котором метилирован цитозин только в одной цепи ДНК), он метилирует цитозин на второй нити в том же сайте. Функция метилирования заключается в активации/инактивации гена. В большинстве случаев, метилирование промоторных областей гена приводит к подавлению активности гена. Показано, что даже незначительные изменения в степени метилирования ДНК могут существенно изменять уровень экспрессии генов.
Модификации гистонов
Хотя модификации аминокислот в гистонах происходят на всей молекуле белка, модификации N-хвостов происходят значительно чаще. Эти модификации включают: фосфорилирование, убиквитинирование, ацетилирование, метилирование, сумоилирование, а также β-гидроксибутирилирование. К примеру, β-гидроксибутирилирование — это эпигенетический регуляторный маркер, который связывает метаболизм с транскрипцией генов.[15]. Ацетилирование является наиболее изученной модификацией гистонов. Так, ацетилирование ацетилтрансферазой 14-го и 9-го лизинов гистона H3 (H3K14ac и H3K9ac, соответственно) коррелирует с транскрипционной активностью в данном районе хромосомы. Это происходит из-за того, что ацетилирование лизина меняет его положительный заряд на нейтральный, что делает невозможным его связь с отрицательно заряженными фосфатными группами в ДНК. В результате происходит отсоединение гистонов от ДНК, что приводит к посадке на «голую» ДНК комплекса SWI/SNF и других транскрипционных факторов которые запускают транскрипцию. Это «цис»-модель эпигенетического регулирования.
Гистоны способны поддерживать своё модифицированное состояние и выступать матрицей для модификации новых гистонов, которые связываются с ДНК после репликации.
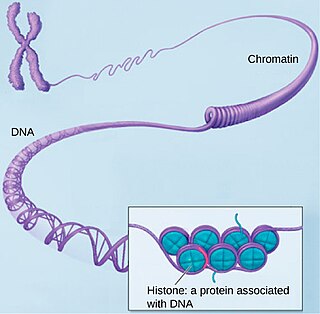
Ремоделирование хроматина
Эпигенетические факторы влияют на активность экспрессии определенных генов на нескольких уровнях, что приводит к изменению фенотипа клетки или организма. Одним из механизмов такого влияния является ремоделирование хроматина. Хроматин — это комплекс ДНК с белками, прежде всего, с белками-гистонами. Гистоны формируют нуклеосому, вокруг которой накручивается ДНК, в результате чего обеспечивается её компактизация в ядре. От густоты расположения нуклеосом в активно экспрессирующихся участках генома зависит интенсивность экспрессии генов. Хроматин без нуклеосом называется открытым хроматином. Ремоделирование хроматина — это процесс активного изменения «густоты» нуклеосом и сродства гистонов с ДНК.
Прионы
Прионные белки обладают аномальной трёхмерной структурой и способны катализировать структурное превращение гомологичных им нормальных белков в себе подобный (прионный) белок, присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои. Прионы — единственные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот. Они осуществляют единственный известный путь передачи информации от белка к белку.
Системы структурной наследственности
У генетически идентичных клеток инфузорий, таких как Tetrahymena и Paramecium, показано наследование различий в характере организации рядов ресничек на поверхности клетки. Экспериментально изменённый узор может быть передан дочерним клеткам. Вероятно, существующие структуры выступают в качестве шаблонов для новых структур. Механизмы такого наследования не ясны, но существуют причины полагать, что у многоклеточных организмов также есть системы структурной наследственности[16][17].
МикроРНК
В последнее время большое внимание привлечено к изучению роли в процессах регуляции генетической активности малых некодирующих РНК (miRNA)[18][19]. МикроРНК могут изменять стабильность и трансляцию мРНК путём комплементарного связывания с 3'-нетранслируемым участком мРНК.
Значение
Эпигенетическое наследование в соматических клетках играет важнейшую роль в развитии многоклеточного организма. Геном всех клеток почти одинаков, в то же время многоклеточный организм содержит различно дифференцированные клетки, которые по-разному воспринимают сигналы окружающей среды и выполняют различные функции. Именно эпигенетические факторы обеспечивают «клеточную память»[13].
Медицина
Как генетические, так и эпигенетические явления оказывают значительное влияние на здоровье человека. Известно несколько заболеваний, которые возникают из-за нарушения метилирования генов, а также из-за гемизиготности по гену, подверженному геномному импринтингу. В настоящее время разрабатывается эпигенетическая терапия, направленная на лечение этих заболеваний посредством воздействия на эпигеном и коррекции нарушений. Для многих организмов доказана связь активности ацетилирования/деацетилирования гистонов с продолжительностью жизни. Возможно, эти же процессы влияют и на продолжительность жизни людей.
Эволюция
Хотя эпигенетику в основном рассматривают в контексте соматической клеточной памяти, существует также ряд трансгенеративных эпигенетических эффектов, при которых генетические изменения передаются потомкам. В отличие от мутаций эпигенетические изменения обратимы и, возможно, могут быть направлены (адаптивны)[13]. Поскольку большинство из них исчезает через несколько поколений, они могут носить характер лишь временных адаптаций. Также активно обсуждается вопрос о возможности влияния эпигенетики на частоту мутаций в определенном гене[20]. Было показано, что семейство белков цитозин-дезаминаз APOBEC/AID принимает участие как в генетической, так и в эпигенетической наследственности, используя схожие молекулярные механизмы. У многих организмов было обнаружено более 100 случаев трансгенеративных эпигенетических явлений[21].
Эпигенетические эффекты у человека
Геномный импринтинг и связанные с ним заболевания
Некоторые заболевания человека связаны с геномным импринтингом, феноменом, при котором аллели гена имеют разный профиль метилирования в зависимости от того, от родителя какого пола они получены. Самыми известными случаями заболеваний, связанных с импринтингом, являются синдром Ангельмана и синдром Прадера — Вилли. Причиной развития обоих является частичная делеция в регионе 15q[22]. Это связано с наличием геномного импринтинга в данном локусе.
Трансгенеративные эпигенетические эффекты
Маркус Пембри (Marcus Pembrey) с соавторами установили, что внуки (но не внучки) мужчин, которые были подвержены голоду в Швеции в XIX веке, менее склонны к сердечно-сосудистым заболеваниям, но сильнее подвержены диабету, что, как считает автор, является примером эпигенетической наследственности[23].
Рак и нарушения развития
Многие вещества имеют свойства эпигенетических канцерогенов: они приводят к увеличению частоты возникновения опухолей, не проявляя при этом мутагенного эффекта (например, диэтилстилбестрола арсенит, гексахлорбензол, соединения никеля). Многие тератогены, в частности диэтилстилбестрол, оказывают специфическое воздействие на плод на эпигенетическом уровне[24][25][26].
Изменения в ацетилировании гистонов и метилировании ДНК приводят к развитию рака простаты путём изменения активности различных генов. На активность генов при раке может влиять питание и образ жизни[27].
В 2008 году Национальный Институт Здоровья США объявил, что 190 миллионов долларов будет потрачено на изучение эпигенетики в течение следующих 5 лет. По мнению некоторых исследователей, которые стали инициаторами выделения средств, эпигенетика может играть бо́льшую роль в лечении заболеваний человека, чем генетика.
Эпигеном и старение
В последние годы накоплено большое количество доказательств того, что эпигенетические процессы играют важную роль на поздних этапах жизни. В частности, при старении происходят широкомасштабные изменения профилей метилирования[2]. Предполагается, что эти процессы находятся под генетическим контролем. Обычно наибольшее количество метилированых цитозиновых оснований наблюдается в ДНК, выделенной из эмбрионов или новорождённых животных, и это количество постепенно уменьшается с возрастом. Подобное снижение уровня метилирования ДНК обнаружено в культивируемых лимфоцитах мышей, хомяков и людей. Оно имеет систематический характер, но может быть ткане- и геноспецифичным. Например, Tra с соавт. (Tra et al., 2002) при сопоставлении более чем 2000 локусов в T-лимфоцитах, изолированных из периферической крови новорожденных, а также людей среднего и старшего возраста, выявили, что 23 из этих локусов с возрастом подвергаются гиперметилированию и 6 — гипометилированию, причём сходные изменения характера метилирования выявлены и в других тканях: поджелудочной железе, легких и пищеводе. Выраженные эпигенетические искажения выявлены у больных прогерией Гетчинсона-Гилфорда.
Предполагается, что деметилирование с возрастом приводит к хромосомным перестройкам за счёт активации мобильных генетических элементов (МГЭ), которые обычно подавляются при помощи метилирования ДНК (Barbot et al., 2002; Bennett-Baker, 2003). Систематическое возрастное снижение уровня метилирования может, по крайней мере отчасти, быть причиной возникновения многих комплексных заболеваний, которые нельзя объяснить с помощью классических генетических воззрений.
Ещё одним процессом, происходящим в онтогенезе параллельно с деметилированием и влияющим на процессы эпигенетического регулирования, является конденсация хроматина (гетерохроматинизация), приводящая с возрастом к снижению генетической активности. В ряде работ возраст-зависимые эпигенетические изменения были продемонстрированы также в половых клетках; направление этих изменений, по всей видимости, является геноспецифичным.
Важным доказательством значимости метилирования ДНК стала разработка эпигенетических часов, с помощью которых стало возможным не только с невероятной точностью вычислять биологический возраст организма, независимо от его физиологических показателей, но и выявлять в нем патологические изменения[28].
См. также
Примечания
Комментарии
- ↑ Кольцов первым предложил молекулярные механизмы, как своей матричной гипотезы, так и понятия эпигенетических механизмов, изменяющих эту матрицу в соответствии с меняющейся средой (Koltzoff N.K.Physikalisch-chemische Grundlage der Morphologie //Biol. Zbl.1928. Bd.48. S.345-369. Koltzoff N.K. Physiologie du de’velopment et genetique // Actualites scientifiques et industrielles. # 254. Paris: Hermann et C-ie. 1935.)
- ↑ Кольцов назвал этот феномен «генотипическими фенокопиями» (Рапопорт И.А. Феногенетический анализ дискретности // Журн. общ. биологии. 1941. Т.2, №3. С. 431-444.)
- ↑ Если Кольцов использовал термин “эпигенетическое явление”, то у Уоддингтона он выглядит как существительное – “эпигенетика”. Читал ли он работу своего предшественника? Скорее всего, да. Ведь он цитировал в другой публикации (Waddington, 1969) работу Кольцова “Наследственные молекулы”. Эта работа вышла брошюрой в том же французском издательстве Hermann в 1939 г. (Koltzoff, 1939). Позже Уоддингтон признавал Кольцова в ряду европейских основателей молекулярной биологии (Waddington, 1969).
Источники
- ↑ Смирнов и Леонов, 2016.
- ↑ 1 2 3 4 Анастасия Берестяная. Эпигеном: параллельная реальность внутри клетки // Наука и жизнь. — 2017. — № 8. — С. 69—75. Архивировано 6 августа 2017 года.
- ↑ New research links common RNA modification to obesity. Дата обращения: 27 декабря 2011. Архивировано 28 мая 2020 года.
- ↑ Reik W. Stability and flexibility of epigenetic gene regulation in mammalian development. (англ.) // Nature. — 2007. — Vol. 447, no. 7143. — P. 425—432. — doi:10.1038/nature05918. — PMID 17522676.
- ↑ Макфейл, 2024, с. 203.
- ↑ Morange M. The attempt of Nikolai Koltzoff (Koltsov) to link genetics, embryology and physical chemistry //J. Bioscience. 2011. V. 36. P. 211–214
- ↑ “Николай Кольцов и молекулярная биология” // Природа. 2015. No 12. С. 78–82
- ↑ 1 2 Раменский Е. “Эпигенетика: Уоддингтон или Кольцов?” // Онтогенез. 2018 - http://ontogenez.org/archive/2018/6/Ramensky_2018_6.pdf Архивная копия от 9 июля 2021 на Wayback Machine
- ↑ Кольцов Н.К. Взгляды Лотси на эволюцию организмов //Природа. 1915. №10. с.1253.
- ↑ «Epigenetics». Bio-Medicine.org. Retrieved 2011-05-21.
- ↑ Holliday R. Mechanisms for the control of gene activity during development. (англ.) // Biological reviews of the Cambridge Philosophical Society. — 1990. — Vol. 65, no. 4. — P. 431—471. — doi:10.1111/j.1469-185X.1990.tb01233.x. — PMID 2265224.
- ↑ Riggs A. D., Martienssen R. F., Russo V. E. A. Introduction // Epigenetic Mechanisms of Gene Regulation / V. E. A. Russo et al. — N. Y.: Cold Spring Harbor Laboratory Press. — С. 1—4.
- ↑ 1 2 3 Watanabe A., Yamada Y., Yamanaka S. Epigenetic regulation in pluripotent stem cells: a key to breaking the epigenetic barrier. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 2013. — Vol. 368, no. 1609. — P. 20120292. — doi:10.1098/rstb.2012.0292. — PMID 23166402.
- ↑ Chandler V. L. Paramutation: from maize to mice. (англ.) // Cell. — 2007. — Vol. 128, no. 4. — P. 641—645. — doi:10.1016/j.cell.2007.02.007. — PMID 17320501.
- ↑ Chen, C., Chen, C., Wang, A., Jiang, Z., Zhao, F., Li, Y., ... & Zhai, G. (2024). ENL reads histone β-hydroxybutyrylation to modulate gene transcription. Nucleic Acids Research, 52(17), 10029–10039. PMID 38880495 PMC 11417371 doi:10.1093/nar/gkae504
- ↑ Jan Sapp, Beyond the Gene. 1987 Oxford University Press. Jan Sapp, «Concepts of organization: the leverage of ciliate protozoa» . In S. Gilbert ed., Developmental Biology: A Comprehensive Synthesis, (New York: Plenum Press, 1991), 229—258. Jan Sapp, Genesis: The Evolution of Biology. — Oxford: Oxford University Press, 2003.
- ↑ Oyama, Susan; Paul E. Griffiths, Russell D. Gray (2001). MIT Press. ISBN 0-262-65063-0.
- ↑ Verdel et al, 2004
- ↑ Matzke M. A., Birchler J. A. RNAi-mediated pathways in the nucleus. (англ.) // Nature reviews. Genetics. — 2005. — Vol. 6, no. 1. — P. 24—35. — doi:10.1038/nrg1500. — PMID 15630419.
- ↑ Rando O. J., Verstrepen K. J. Timescales of genetic and epigenetic inheritance. (англ.) // Cell. — 2007. — Vol. 128, no. 4. — P. 655—668. — doi:10.1016/j.cell.2007.01.023. — PMID 17320504.
- ↑ Jablonka E., Raz G. Transgenerational epigenetic inheritance: prevalence, mechanisms, and implications for the study of heredity and evolution. (англ.) // The Quarterly review of biology. — 2009. — Vol. 84, no. 2. — P. 131—176. — PMID 19606595.
- ↑ Knoll J. H., Nicholls R. D., Magenis R. E., Graham J. M. Jr., Lalande M., Latt S. A. Angelman and Prader-Willi syndromes share a common chromosome 15 deletion but differ in parental origin of the deletion. (англ.) // American journal of medical genetics. — 1989. — Vol. 32, no. 2. — P. 285—290. — doi:10.1002/ajmg.1320320235. — PMID 2564739.
- ↑ Pembrey M. E., Bygren L. O., Kaati G., Edvinsson S., Northstone K., Sjöström M., Golding J. Sex-specific, male-line transgenerational responses in humans. (англ.) // European journal of human genetics : EJHG. — 2006. — Vol. 14, no. 2. — P. 159—166. — doi:10.1038/sj.ejhg.5201538. — PMID 16391557.
- ↑ Bishop J. B., Witt K. L., Sloane R. A. Genetic toxicities of human teratogens. (англ.) // Mutation research. — 1997. — Vol. 396, no. 1-2. — P. 9—43. — doi:10.1016/S0027-5107(97)00173-5. — PMID 9434858.
- ↑ Gurvich N., Berman M. G., Wittner B. S., Gentleman R. C., Klein P. S., Green J. B. Association of valproate-induced teratogenesis with histone deacetylase inhibition in vivo. (англ.) // FASEB journal : official publication of the Federation of American Societies for Experimental Biology. — 2005. — Vol. 19, no. 9. — P. 1166—1168. — doi:10.1096/fj.04-3425fje. — PMID 15901671.
- ↑ Smithells D. Does thalidomide cause second generation birth defects? (англ.) // Drug safety. — 1998. — Vol. 19, no. 5. — P. 339—341. — PMID 9825947.
- ↑ Ornish D., Magbanua M. J., Weidner G., Weinberg V., Kemp C., Green C., Mattie M. D., Marlin R., Simko J., Shinohara K., Haqq C. M., Carroll P. R. Changes in prostate gene expression in men undergoing an intensive nutrition and lifestyle intervention. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2008. — Vol. 105, no. 24. — P. 8369—8374. — doi:10.1073/pnas.0803080105. — PMID 18559852.
- ↑ Джагаров Д.Э (2018). Эпигенетика старения: прорывное направление геронтологии? Архивная копия от 21 февраля 2020 на Wayback Machine УСПЕХИ ГЕРОНТОЛОГИИ, 31(5), 628-632 PMID 30638314
Литература
- Эпигенетика / С. М. Закиян, В. В. Власов, Е. В. Дементьева. — Новосибирск: Изд-во СО РАН, 2012. — 592 с. — 300 экз. — ISBN 978-5-7692-1227-7.
- Несса Кэри. Эпигенетика: как современная биология переписывает наши представления о генетике, заболеваниях и наследственности. — Ростов н/Д.: Феникс, 2012. — ISBN 978-5-222-18837-8.
- Тереза Макфейл. Аллергия. Жестокие игры иммунитета = Theresa MacPhail. Allergic: Our Irritated Bodies in a Changing World. — М.: Альпина Паблишер, 2024. — С. 448. — ISBN 978-5-9614-3272-5.
- Rivera, C. M., & Ren, B. (2013) Mapping Human Epigenomes. Cell, 155(1), 39-55. https://dx.doi.org/10.1016/j.cell.2013.09.011
- Taiping Chen & Sharon Y. R. Dent (Feb. 2014). Chromatin modifiers and remodellers: regulators of cellular differentiation. Nature Reviews Genetics, 15(2), 93-106 doi:10.1038/nrg3607
- Suhas S. P. Rao, et al.(2014). A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell, doi:10.1016/j.cell.2014.11.021
- DNA Methylations and Histone Modifications: Links to Diseases
- C David Allis, Danny Reinberg, Thomas Jenuwein, Marie-Laure Caparros Epigenetics 1st edition. Chegg Inc. www.chegg.com.
- Armstrong, Lyle Epigenetics (1st Edition) Published November 24th 2013 by Garland Science eTextbook
- C. David Allis, Marie-Laure Caparros, Thomas Jenuwein, Danny Reinberg Epigenetics, Second Edition Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2015 ISBN 978-1-936113-59-0
- Александр Вайсерман (2018). Эпигенетика. Видеолекция. Искать на канале youtube по ссылке DzyR5MlvzHM
- Zsidó, B. Z., & Hetényi, C. (2020). Molecular Structure, Binding Affinity, and Biological Activity in the Epigenome. International Journal of Molecular Sciences, 21(11), 4134. doi:10.3390/ijms21114134 PMC 7311975 PMID 32531926
- Смирнов, В. В. Эпигенетика : теоретические аспекты и практическое значение : [арх. 25 января 2017] / В. В. Смирнов, Г. Е. Леонов // Лечащий врач : журн. — 2016. — № 12.