
Гисто́ны — обширный класс ядерных белков, выполняющих две основные функции: они участвуют в упаковке нитей ДНК в ядре и в эпигенетической регуляции таких ядерных процессов, как транскрипция, репликация и репарация. Существует пять различных типов гистонов H1/Н5, H2A, H2B, H3, H4. Гистоны H2A, H2B, H3, H4, называемые кóровыми гистонами, формируют нуклеосому, представляющую собой белковую глобулу, вокруг которой накручена нить ДНК. Гистон H1/H5, называемый линкерным гистоном, связывается с внешней стороной нуклеосомы, фиксируя на ней нить ДНК. В хроматине гистоны составляют 25—40 % сухого веса. Благодаря высокому содержанию лизина и аргинина гистоны проявляют сильно оснóвные свойства. Гистоны непосредственно контактируют с ДНК и способны нейтрализовать отрицательный заряд фосфатных групп ДНК за счёт положительных зарядов аминокислотных остатков. Последовательность аминокислот в этих белках является консервативной и практически не различается в организмах различных таксонов. Гистоны присутствуют в ядрах эукариотических клеток; у бактерий гистонов нет, но они выявлены у архей группы Euryarchaea.
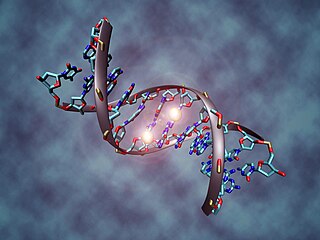
Метилирование ДНК — это модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетической составляющей генома.

Я́дрышко — немембранный внутриядерный субкомпартмент, присущий всем без исключения эукариотическим организмам. Представляет собой комплекс белков и рибонуклеопротеидов, формирующийся вокруг участков ДНК, которые содержат гены рРНК — ядрышковых организаторов. Основная функция ядрышка — образование рибосомных субъединиц.

Эухромати́н, также активный или «открытый хромати́н» — участки хроматина, которые представляет собой неплотную и легко упакованную форму, обогащённую генами и часто находящуюся в состоянии активной транскрипции. Эухроматин отличается от гетерохроматина, который плотно упакован и менее доступен для транскрипции. Около 92 % генома человека является эухроматичным.

Антисмысловы́е РНК — одноцепочечные РНК, которые комплементарны мРНК, транскрибируемой в клетке, или гену-мишени. Механизмы действия антисмысловых РНК весьма разнообразны, они могут как подавлять, так и активировать экспрессию гена-мишени. Природные антисмысловые РНК есть и у прокариот, и у эукариот; они относятся к длинным некодирующим РНК как РНК длиной более 200 нуклеотидов. Синтетические антисмысловые РНК нашли широкое применение у исследователей в качестве инструмента для нокдауна генов. Антисмысловые РНК также находят медицинское применение.
Подавление экспрессии генов — это общий термин, описывающий эпигенетический процесс регуляции генов. При этом последовательность нуклеотидов не изменяется, а лишь прекращается экспрессия соответствующего гена. Для выключения генов в лабораторных условиях применяют метод нокдауна генов.
Эпигенетика — раздел генетики. Эпигенетика изучает наследуемые изменения активности генов во время роста и деления клеток — изменения синтеза белков, вызванных механизмами, не изменяющими последовательность нуклеотидов в ДНК. Эпигенетические изменения сохраняются в ряде митотических делений соматических клеток, а также могут передаваться следующим поколениям. Регуляторы синтеза белка — метилирование и деметилирование ДНК, ацетилирование и деацетилирование гистонов, фосфорилирование и дефосфорилирование транскрипционных факторов и другие внутриклеточные механизмы.

Энциклопедия элементов ДНК — международный исследовательский консорциум, организованный и финансируемый американским Национальным институтом исследований генома человека в сентябре 2003 года. Цель его работы — произвести полный анализ функций элементов генома человека, это один из самых важных проектов NHGRI после успешного завершения проекта «Геном человека». Все данные, полученные в ходе реализации проекта, будут опубликованы в общедоступных базах данных.

Откры́тый хромати́н — небольшие участки хроматина, свободные от нуклеосом. Посадке нуклеосом, как правило, препятствуют связанные с хроматином белковые факторы, узнающие определённые последовательности ДНК. К числу таких белков относятся транскрипционные факторы, ДНК- или РНК-полимеразы. Открытый хроматин часто совпадает с цис-регуляторными последовательностями, а именно: промоторами, энхансерами, инсуляторами, сайленсерами, участками начала репликации ДНК. Размер открытых участков хроматина обычно составляет несколько сотен пар нуклеотидов, в среднем около 300 п.н.

Нуклеоли́н — белок, имеющийся у высших эукариот. У человека он кодируется геном NCL, расположенным на 2-й хромосоме в локусе 2q37.1.

Фибриллари́н — ядрышковый белок, у человека кодируется геном FBL, локализованным на 19-й хромосоме. Основной функцией фибрилларина является участие в транскрипции и процессинге рРНК, поэтому он часто используется как маркер активных ядрышек. Фибрилларин является метилтрансферазой, то есть переносит метильную группу с S-аденозилметионина на 2'-гидроксильную группу рибозы в молекуле РНК-мишени. Кроме того, фибрилларин опосредует метилирование остатка глутамина Gln105 в гистоне Н2А. Белки, по структуре и функциям соответствующие фибрилларину, были найдены и у архей, которые являются прокариотами и не имеют ядрышек. Повышенный уровень фибрилларина обнаруживается в случае многих раковых заболеваний. Кроме того, фибрилларин может взаимодействовать со многими вирусными белками.
Гистондеацетила́за 4 — белок, кодируемый у человека геном HDAC4, расположенным на 2-й хромосоме. Как и все ферменты группы гистондеацетилаз, близкой к сиртуинам, гистондеацетилаза 4 катализирует удаление ацетильных групп с остатков лизина в N-концевой части коровых гистонов, что изменяет структуру хроматина. Деацетилирование гистонов является одним из механизмов транскрипционной и эпигенетической регуляции, оказывает влияние на ход клеточного цикла и участвует в регуляции развития. Работа HDAC4 регулируется путём различных посттрансляционных модификаций и взаимодействий с разнообразными белками, иногда тканеспецифичными. Нарушение работы HDAC4 приводит к развитию многих заболеваний, в том числе раковых, поэтому ингибиторы HDAC4 могут иметь важное медицинское применение.

В связи с накоплением огромного количества информации о последовательностях генов, в настоящее время, для выявления функций генов, часто используют методы обратной генетики. Исследователи манипулируют последовательностями генов, изменяя или выключая тот или иной ген, и анализируют, к каким изменениям это приводит. Это путь обратной генетики: от гена к признаку/фенотипу. Прямая и обратная генетика – не взаимоисключающие подходы, а дополняющие друг друга в изучении функции гена.
Нуклеофозми́н — ядрышковый белок, у человека кодируется геном NPM1, локализованным на 5-й хромосоме. Нуклеофозмин перемещается между ядром и цитоплазмой и действует как многофункциональный шаперон нуклеиновых кислот, принимающий участие в таких процессах, как биогенез рибосом, ремоделирование хроматина, регуляция митоза, поддержание стабильности генома, репарация ДНК и транскрипция. Нарушения в работе нуклеофозмина могут приводить к развитию злокачественных новообразований и других заболеваний; в частности, мутации, затрагивающие его ген, приводят к развитию острого миелоидного лейкоза.
Парамута́ция — взаимодействие двух аллелей одного локуса, при котором один аллель вызывает наследуемые изменения в другом аллеле. Эти изменения могут заключаться в изменении паттерна метилирования ДНК или модификации гистонов. Аллель, индуцирующий эти изменения, называется парамутагенным, а тот аллель, который эпигенетически изменяется, называется парамутабельным. Парамутабельный аллель может иметь изменённые уровни экспрессии, которые могут сохраняться у потомства, унаследовавшего этот аллель, даже в отсутствие парамутагенного аллеля. Парамутации могут иметь место, например, у генетически идентичных растений, демонстрирующих совершенно разные фенотипы.

Я́дерные спе́клы, или спе́клы, или B-снурпосо́мы, или компа́ртменты фа́кторов спла́йсинга, или доме́ны SC-35, или кла́стеры интерхромати́новых гра́нул — ядерные тельца, регулирующие сплайсинг. В ядерных спеклах находятся факторы сплайсинга и малые ядерные рибонуклеопротеины. Изменения в белковом составе и функционировании ядерных спекл приводят к изменениям в альтернативном сплайсинге пре-мРНК, поэтому считается, что ключевой функцией ядерных спекл является регуляция доступности факторов сплайсинга в сайтах транскрипции. Недавние исследования показали, что в ядерных спеклах также находятся белки, задействованные в регуляции локализации хромосом, модификации хроматина, транскрипции, процессинге 3'-концов транскриптов, модификации мРНК, белки, полностью покрывающие мРНК, и мРНК-рибонуклеопротеины, поэтому ядерные спеклы рассматриваются как крупнейшие центры регуляции всех этапов экспрессии ядерных генов.
Эпигено́мика — раздел молекулярной биологии, изучающий совокупность эпигенетических модификаций генетического материала клетки с помощью высокопроизводительных методов. Эпигеномика аналогична геномике и протеомике, которые изучают геном и протеом клетки, соответственно.

Эпигенетика — это изучение изменений в экспрессии генов. Экспрессия происходит посредством метилирования ДНК, ацетилирования гистонов и модификации микро-РНК. Эпигенетические изменения подобного рода могут наследоваться и тогда они влияют на эволюцию. Современные исследования активно ведутся и уже понятно что эпигенетика оказывает большое влияние на все живые организмы.
BEND3 — белок, содержащий четыре домена BEN, который, связывается с ДНК избирательным для последовательности и наличия метилирования ДНК образом — исключительно на участках с промоторами генов и вызывающий гетерохроматинизацию хроматина Связывание BEND3 со специфическим генным локусом, в частности с геном рибосомальной ДНК в ядрышке приводит к репрессии транскрипции, вероятно, за счет изменения структуры хроматина, а также стабильной ассоциации комплекса PRC2 с двухвалентными генами. BEND3 является SUMOилированным белком, и эта модификация важна для его репрессивной функции, но не для его ассоциации с хроматином. Гиперэкспрессия BEND3 вызывает конденсацию хроматина и остановку клеточного цикла. Многие гены, репрессированные BEND3, способствуют дифференцировке клеток. Связывание BEND3 с этими генами блокирует их экспрессию и поддерживая плюрипотентный статус клеток, подобный стволовым клеткам предотвращет преждевременный переход клеток в дифференцированное состояние, что необходимо для нормального развития. Связывание BEND3 с промоторами факторов, ассоциированных с дифференцировкой и ключевых генов регуляторов клеточного цикла, таких как CDKN1A, кодирующий ингибитор клеточного цикла - белок p21 необходимо для тонкой настройки экспрессии этих генов, путем повышения на них уровня эпигенетической метки H3K27me3 на коровом гистоне H3 нуклеосомы, что приводит к ограничению синтеза РНК РНК-полимеразой II.













