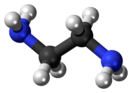
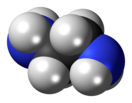
Этилендиамин
| Этилендиамин | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование | 1,2-диаминоэтан | ||
| Традиционные названия | Этилендиамин, диаминоэтан | ||
| Хим. формула | C2H8N2 | ||
| Рац. формула | C2H8N2 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 60.1 г/моль | ||
| Плотность | 0,899(при 20°С) | ||
| Энергия ионизации | 8,6 эВ[1][2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 11 °C | ||
| • кипения | 117-119 °C | ||
| • вспышки | 38 °C | ||
| • самовоспламенения | 380 °C | ||
| Пределы взрываемости | 2.7–16 % | ||
| Мол. теплоёмк. | 172.59 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −63.55–−62.47 кДж/моль | ||
| Давление пара | 1.3 кПа (при 20 °C) | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,98[3] | ||
| Оптические свойства | |||
| Показатель преломления | 1.4565 | ||
| Структура | |||
| Дипольный момент | 6,6E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 107-15-3 | ||
| PubChem | 3301 | ||
| Рег. номер EINECS | 203-468-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | KH8575000 | ||
| ChEBI | CHEBI:30347 | ||
| Номер ООН | 1604 | ||
| ChemSpider | 13835550 | ||
| Безопасность | |||
| Предельная концентрация | 2 мг/м³ | ||
| ЛД50 | 1200 мг/кг | ||
| Токсичность | умеренно-токсичен, является ирритантом | ||
| Фразы риска (R) | R10, R21/22, R34, R42/43 | ||
| Фразы безопасности (S) | (S1/2), S26, S36/37/39, S45 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Этилендиамин (1,2-диаминоэтан) H2NCH2CH2NH2 — органическое соединение класса аминов. Это широко используемый строительный блок в химическом синтезе, так что уже в 1998 году его производство составляло 500 млн кг.[4]
Свойства
Жидкость без цвета с запахом аммиака, дымит при контакте с влажным воздухом. tkип 116,5 °C, tпл 8,5 °C, плотность 0,899 г/см³ (20 °C); Этилендиамин хорошо растворяется в воде (с разогреванием раствора), этаноле, хуже — в эфире, нерастворим в бензоле и других углеводородах. Является сильным основанием.
Имея в своей молекуле две аминогруппы, образует с кислотами два ряда солей. С некоторыми металлами (например, Cu, Mn, Co) образует комплексные соединения.
Динитрат этилендиамина при нагревании превращается в этилендинитрамин, являющийся взрывчатым веществом:
Вступает в реакции конденсации: при повышенных температурах и давлении и присутствии катализаторов превращается в пиперазин; при конденсации с 1,2-дикетонами - 2,3-дигидропиразинами; при реакции с мочевиной - этиленмочевину (2-имидазолининон).
Применение
Этилендиамин применяется для получения этилендиаминтетрауксусной кислоты взаимодействием с хлоруксусной кислотой. Его соли с жирными кислотами используются как смягчающие агенты при производстве текстиля. Также этилендиамин применяется в производстве красителей, эмульгаторов, стабилизаторов латексов, пластификаторов и фунгицидов, лекарственных препаратов (супрастин, эуфиллин, ранитидин).
Получение
Основным способом синтеза этилендиамина в промышленности является взаимодействие аммиака с дихлорэтаном:[5]
Кроме того, его можно получить по реакции каталитического гидрирования смеси моноэтаноламина с аммиаком при 150—230 °C.
К другим методам синтеза относятся реакция этилена с аммиаком либо формальдегида с аммиаком и циановодородом.
Токсичность
1,2-диаминоэтан обладает умеренно-токсическим действием[6]. ЛД50 на крысах при пероральном введении составляет 1200 мг/кг.
Этилендиамин в больших количествах может раздражать кожу и слизистые оболочки верхних дыхательных путей, вызывает поражение печени.
ПДК паров в атмосферном воздухе составляет 0,03 мг/м3, в воздухе рабочей зоны 2 мг/м3, в воде водоёмов 0,2 мг/м3.
Вещество относится к III классу опасности по ГОСТ 12.1.005-88.
Литература
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.
- Кремлёв А. М., Менделеев Д. И.,. Этилендиамин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки
- ↑ http://www.cdc.gov/niosh/npg/npgd0269.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Hall H. K. Correlation of the Base Strengths of Amines 1 (англ.) // Journal of the American Chemical Society / P. J. Stang — ACS, 1957. — Vol. 79, Iss. 20. — P. 5441—5444. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01577A030
- ↑ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi:10.1002/14356007.a02_001
- ↑ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 245, Wiley VCH
- ↑ name=https://www.safework.ru_Этилендиамин (недоступная ссылка)