Эхинокандины

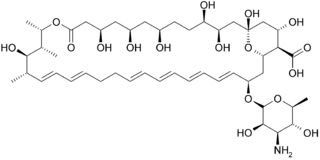
Эхинокандины — противогрибковые препараты, препятствующие синтезу глюканов в клеточной стенке через неконкурентное ингибирование фермента 1,3-β-глюкан-синтазы[1][2], в связи с чем их (совместно с папулокандинами) называют «противогрибковыми пенициллинами»[3], так как пенициллин имеет аналогичный механизм действия против бактерий, а не грибов. Бета-глюканы это углеводные полимеры, перекрёстно-связанные с другими компонентами клеточной стенки грибов (бактериальным эквивалентом является пептидогликан). Каспофунгин, микафунгин и анидулафунгин являются полусинтетическими производными эхинокандина, которые нашли практическое применение из-за их растворимости, противогрибкового спектра и своих фармакокинетических свойств[4].
Медицинское использование
Утверждённые препараты и препараты-кандидаты этого класса обладают фунгицидными свойствами против некоторых дрожжей (большинство видов рода Candida, но не против Cryptococcus, Trichosporon и Rhodotorula). Эхинокандины также проявляют активность в отношении кандидозной биоплёнки, особенно в синергетической активности c амфотерицином B и в аддитивной активности с флуконазолом. Эхинокандины являются фунгистатическим в отношении некоторых форм Aspergillus (но не Fusarium и Rhizopus), и менее активен в отношении диморфных грибов (Blastomyces и Histoplasma). Они обладают некоторой активностью в отношении спор грибов Pneumocystis carinii. Каспофунгин применяется в лечении фебрильной нейтропении и в качестве терапии спасения при лечении инвазивного аспергиллёза[5]. Микафунгин используется для профилактики кандидозной инфекции у пациентов при трансплантации гемопоэтических стволовых клеток[5].
Побочные эффекты
Токсичность эхинокандинов является редкостью. Её проявление было связано с повышением уровней аминотрансфераз и щелочной фосфатазы[6].
Химия

На современном этапе клинически применяемые эхинокандины являются полусинтетическим продуктом пневмокандинов, которые являются химически липопептидами по своей природе, состоящими из крупных циклических (гекса)пептоидов. Каспофунгин, микафунгин и анидулафунгин схожи с циклическими гексапептидными антибиотиками, связанными с длинными модифицированными N-связанными цепочками остатков жирных кислот. Цепочки действуют как якоря на грибковой клеточной мембране, облегчая противогрибковое действие[7]. Из-за ограниченной биодоступности энтеральных (принимаемых через рот) форм эхинокандинов, их вводят внутривенно.
Механизм действия
Эхинокандины неконкурентно ингибируют синтез 1,3-β-D-глюкана, важного компонента клеточной стенки грибов, который отсутствует в клетках млекопитающих[8]. Разрушение бета-глюкана подавляет сопротивление против осмотических сил, что приводит к лизису клетки[9]. Они обладают фунгистатическим действием в отношении грибов aspergillus и фунгицидной активностью по отношению к большинству представителей рода Candida, в включая флуконазол-резистентные штаммы[5]. In vitro и на мышиных моделях показано, что эхинокандины могут также способствовать усилению иммунных ответов организма-хозяина, выделяя очень антигенные эпитопы бета-глюкана, которые могут ускорять клеточное узнавание и воспалительные реакции[10].
Устойчивость
Устойчивость к эхинокандинам встречается редко. Тем не менее, тематические исследования показали определённую устойчивость у С. albicans, С. glabrata, С. lusitaniae, С. tropicalis и С. parapsilosis. Их устойчивость обусловлена изменениями глюкан-синтазы (Fks1-Fks2 комплекс), а также избыточной экспрессией выкачивающих белков-насосов.
Фармакокинетика
Из-за своего большого молекулярного веса эхинокандины обладают плохой биодоступностью при пероральном приёме, потому их вводят через внутривенные инфузии. Кроме того, их большие структуры ограничивают проникновение в спинномозговую жидкость, мочу, и глаза. Эхинокандины имеют высокое сродство с белками сыворотки крови. У них нет основных взаимодействий с насосами P-гликопротеина или CYP450. Каспофунгин обладает трёхфазной нелинейной фармакокинетикой, в то время как микафунгин (метаболизируется в печени посредством арилсульфатазы, катехол-о-метилтрансферазы, и гидроксилирования) и анидулафунгин (распадается спонтанно и выводится в основном в виде метаболита с мочой) выводятся линейно[6][11]. Молодые пациенты демонстрируют более высокие темпы элиминации микафунгина и каспофунгина[12].
Взаимодействие
Каспофунгин влияет на метаболизм циклоспорина; микафунгин влияет на метаболизм сиролимуса (рапамицин); анидулафунгин не нуждается в коррекции дозы препарата в сочетании с циклоспорином, такролимусом, или вориконазолом[13][].
Преимущества
Преимущества эхинокандинов:
- широкий спектр действия (особенно против всех видов Candida), что позволяет назначать их эмпирически при фебрильной нейтропении и во время трансплантации стволовых клеток;
- могут быть использованы в случае флуконазол-устойчивого кандидоза или в качестве второй линии для рефрактерного аспергиллёза;
- длительный период полувыведения (полифазная элиминация: Альфа-фаза 1-2 часа + бета-фаза 9-11 часов + гамма-фаза 40-50 часов);
- низкая токсичность: изолированное высвобождение гистамина (3 %), лихорадка (2.9 %), тошнота и рвота (2.9 %), флебит в месте инъекции (2.9 %), очень редко аллергия и анафилаксия;
- не ингибитор, не индуктор и не субстрат системы цитохрома P450 или p-гликопротеина, следовательно, обладает минимальными лекарственными взаимодействиями;
- отсутствие противопоказаний при почечной недостаточности и гемодиализе;
- нет необходимости коррекции дозы в зависимости от возраста, пола, расы;
- лучше (или не менее эффективно), чем амфотерицин B и флуконазол против молочницы.
Недостатки
Недостатки эхинокандинов:
- эмбриотоксичность[3] (категория C) — следует избегать во время беременности;
- нуждается в коррекции дозы при заболеваниях печени;
- плохое проникновение в ткани глаза для лечения грибкового эндофтальмита[14].
Примеры
Список эхинокандинов:
- Пневмокандины (циклические гексапептиды, связанные с длинной цепочкой жирной кислоты)
- Эхинокандин B не используется из-за риска гемолиза
- Цилофунгин снят с испытаний из-за токсичности растворителя
- Каспофунгин (торговое наименование Cancidas, компания Merck)
- Микафунгин (FK463) (торговое название Mycamine, компания Astellas Pharma)
- Анидулафунгин (VER-002, V-эхинокандин, LY303366) (торговое название Eraxis, компания Pfizer)
История

Открытие эхинокандинов вытекает из исследований липосахаридов (производные жирных кислот и дисахарида) папулокандинов изолированных из штамма Papularia sphaerosperma (Pers.), блокировали 1,3-β-глюкан-синтазу, и действовали только на Candida spp. Скрининг натуральных продуктов грибкового брожения в 1970-х годах привёл к открытию эхинокандинов, новой группы противогрибковых препаратов широкого спектра активности против Candida spp. В 1974 году одним из первых эхинокандинов пневмокандинового типа был открыт эхинокандин B, но его нельзя было использовать в клинической практике из-за высокого риска гемолиза. Скрининг полусинтетических аналогов эхинокандинов привёл к созданию цилофунгина, первого аналога эхинофунгина, который подвергся клиническим испытаниям, но в 1980 году он был исключен из испытаний из-за токсичности растворителя, необходимого для системного назначения. Позднее были найдены полусинтетические аналоги эхинокандинов с такой же противогрибковой активностью, но менее токсичные. Первым из новых эхинокандинов был одобрен каспофунгин, а позже были утверждены микафунгин и анидулафунгин. Все эти препараты обладают низкой биодоступностью, потому применяются только внутривенно. Эхинокандины стали сейчас одним из лекарств первой линии для терапии против грибов рода Candida при не установленном точно возбудителе, и даже в качестве противогрибковой профилактики во время трансплантации кроветворных стволовых клеток (трансплантации костного мозга).
Примечания
- ↑ Morris M.I., Villmann M. Echinocandins in the management of invasive fungal infections, part 1 (англ.) // Am J Health Syst Pharm[англ.] : journal. — 2006. — September (vol. 63, no. 18). — P. 1693—1703. — doi:10.2146/ajhp050464.p1. — PMID 16960253. Архивировано 14 марта 2020 года.
- ↑ Morris M.I., Villmann M. Echinocandins in the management of invasive fungal infections, Part 2 (англ.) // Am J Health Syst Pharm[англ.] : journal. — 2006. — October (vol. 63, no. 19). — P. 1813—1820. — doi:10.2146/ajhp050464.p2. — PMID 16990627. Архивировано 14 марта 2020 года.
- ↑ 1 2 Jennifer Long. New Antifungal Agents Additions to the Existing Armamentarium. Part 1 (англ.). Pharmacotherapy Update, Volume VI, Number 3 (июнь 2003). Дата обращения: 9 марта 2016. Архивировано 10 мая 2017 года.
- ↑ Debono M., Gordee R. S. Antibiotics that inhibit fungal cell wall development. (англ.) // Annual review of microbiology. — 1994. — Vol. 48. — P. 471—497. — doi:10.1146/annurev.mi.48.100194.002351. — PMID 7826015.
- ↑ 1 2 3 Sucher A. J., Chahine E. B., Balcer H. E. Echinocandins: the newest class of antifungals. (англ.) // The Annals of pharmacotherapy. — 2009. — Vol. 43, no. 10. — P. 1647—1657. — doi:10.1345/aph.1M237. — PMID 19724014.
- ↑ 1 2 Cancidas. Prescribing information-(caspofungin acetate) for injection. Merck & Co Inc, Whitehouse Station, NJ 2008.
- ↑ Denning D. W. Echinocandin antifungal drugs. (англ.) // Lancet (London, England). — 2003. — Vol. 362, no. 9390. — P. 1142—1151. — doi:10.1016/S0140-6736(03)14472-8. — PMID 14550704.
- ↑ Douglas C. M. Fungal beta(1,3)-D-glucan synthesis. (англ.) // Medical mycology. — 2001. — Vol. 39 Suppl 1. — P. 55—66. — doi:10.1080/mmy.39.1.55.66. — PMID 11800269.
- ↑ Beauvais A., Latgé J. P. Membrane and cell wall targets in Aspergillus fumigatus. (англ.) // Drug resistance updates : reviews and commentaries in antimicrobial and anticancer chemotherapy. — 2001. — Vol. 4, no. 1. — P. 38—49. — doi:10.1054/drup.2001.0185. — PMID 11512152.
- ↑ Wheeler R. T., Fink G. R. A drug-sensitive genetic network masks fungi from the immune system. (англ.) // PLoS pathogens. — 2006. — Vol. 2, no. 4. — P. e35. — doi:10.1371/journal.ppat.0020035. — PMID 16652171.
- ↑ Boucher H. W., Groll A. H., Chiou C. C., Walsh T. J. Newer systemic antifungal agents : pharmacokinetics, safety and efficacy. (англ.) // Drugs. — 2004. — Vol. 64, no. 18. — P. 1997—2020. — doi:10.2165/00003495-200464180-00001. — PMID 15341494.
- ↑ Lehrnbecher T., Groll A. H. Micafungin: a brief review of pharmacology, safety, and antifungal efficacy in pediatric patients. (англ.) // Pediatric blood & cancer. — 2010. — Vol. 55, no. 2. — P. 229—232. — doi:10.1002/pbc.22449. — PMID 20583216.
- ↑ Harrison’s Principle of Internal Medicine
- ↑ Gauthier G. M., Nork T. M., Prince R., Andes D. Subtherapeutic ocular penetration of caspofungin and associated treatment failure in Candida albicans endophthalmitis. (англ.) // Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. — 2005. — Vol. 41, no. 3. — P. e27–28. — doi:10.1086/431761. — PMID 16007519.