Языковая липаза
| Языковая липаза | |
|---|---|
| Идентификаторы | |
| Шифр КФ | 3.1.1.3 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
Лингвальная липаза (Языковая липаза) (шифр КФ 3.1.1.3) является членом семейства пищеварительных ферментов, называемых триацилглицеринлипазами, которые используют каталитическую триаду аспартата, гистидина и серина для гидролиза средних и длинноцепочечных триглицеридов до частичных глицеридов и свободных жирных кислот. Фермент, попадающий в рот вместе со слюной, катализирует первую реакцию переваривания пищевых липидов, причём диглицериды являются основным продуктом реакции[1]. Однако из-за уникальных характеристик лингвальной липазы, в том числе оптимума pH 4,5-5,4 и её способности катализировать реакции без солей жёлчных кислот, липолитическая активность распространяется и на желудок[2]. Высвобождение фермента сигнализируется вегетативной нервной системой после приёма внутрь, в это время серозные железы под окружными и листовыми язычными сосочками на поверхности языка[3] выделяют лингвальную липазу в бороздки окружных и листовидных сосочков, локализованных вместе с рецепторы вкуса жира. Гидролиз пищевых жиров важен для всасывания жира в тонком кишечнике, так как длинноцепочечные триацилглицериды не могут абсорбироваться, и до 30 % жира гидролизуется в течение 1-20 минут после приёма одной только лингвальной липазой[2].
Предлагаемый механизм
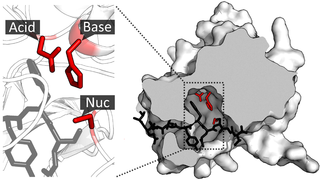
Лингвальная липаза использует каталитическую триаду, состоящую из аспарагиновой кислоты-203 (Asp), гистидина-257 (His) и серина-144 (Ser), чтобы инициировать гидролиз триглицерида до диацилглицерида и свободной жирной кислоты. Во-первых, существует серия депротонирования, которая делает серин лучшим нуклеофилом. Затем неподелённая пара кислорода серина подвергается нуклеофильному присоединению либо к первому, либо к третьему карбонилу триацилглицерина. Затем электроны, которые двигались, чтобы сформировать карбонил, переносятся обратно вниз, чтобы преобразовать карбонил. Затем уходящая группа диацилглицерина протонируется His-257. После ещё одного раунда депротонирования неподелённая пара на кислороде воды подвергается нуклеофильному присоединению к карбонилу, преобразованному на предыдущем этапе. Электроны, которые вышли из карбонила, возвращаются вниз, чтобы преобразовать его и запустить Ser, который снова вызывает цепь депротонирования. Конечными продуктами реакции являются консервативная каталитическая триада, диацилглицерин и свободная жирная кислота. Моноацилглицерид также присутствует в более низкой концентрации и образуется после второго цикла гидролиза по тому же механизму. Он действует на триглицериды, помогая расщеплять пищу в составе слюны.

Кистозный фиброз
Пациенты с муковисцидозом (МВ) имеют 85 % шанс дополнительно испытать эффекты внешнесекреторной недостаточности поджелудочной железы[4]. В самых крайних случаях у этих пациентов не будет вырабатываться липаза поджелудочной железы, но даже когда фермент полностью отсутствует, пищевой жир все равно всасывается[4]. Исследования показали, что даже в этих случаях лингвальная липаза присутствует в нормальных количествах[5] и составляет более 90 % общей активности липазы в двенадцатиперстной кишке[2]. Это может быть связано с тем, что лингвальная липаза имеет низкий оптимум pH и, таким образом, может оставаться активной, проходя через желудок в двенадцатиперстную кишку, где у пациентов с МВ низкий pH. Таким образом, было предложено, что возможным вариантом лечения внешнесекреторной недостаточности поджелудочной железы была бы заместительная ферментная терапия с использованием лингвальной липазы, увеличивающая абсорбцию пищевых жиров и снижающая риск недоедания. Предложенный механизм лингвальной липазы, предпочтительно расщепляющей триацилглицерины с короткой и средней цепью, обеспечивает средства для абсорбции без необходимости образования мицелл и хиломикронов. Свободные жирные кислоты с короткой и средней цепью могут абсорбироваться непосредственно через клетки слизистой оболочки в кровоток без дополнительной упаковки и, следовательно, играют решающую роль в питании пациентов с МВ (и новорождённых).
Переваривание жира у новорождённых
В матке плод зависит от диеты с высоким содержанием углеводов, и лингвальные, а также желудочные липазы присутствуют у плода с 26 недель беременности. После рождения жир в материнском молоке или заменителе молока становится основным источником питания. Показатели абсорбции пищевых жиров у новорождённых намного ниже, чем у взрослых, 65-80 % по сравнению с> 95 % соответственно, что может быть связано с низкой активностью липазы поджелудочной железы[1]. Кроме того, молочный жир не является хорошим субстратом для липазы поджелудочной железы. Этот факт, в сочетании с дефицитом солей жёлчных кислот и низким pH во всем желудочно-кишечном тракте новорождённого, требует, чтобы лингвальная липаза была основным ферментом, катализирующим гидролиз диетического жира. Эта ферментативная активность наблюдалась уже в 26-недельном гестационном возрасте, при этом способность гидролизовать пищевые жиры варьировалась в зависимости от зрелости пищеварительного тракта[1].
Примечания
- ↑ 1 2 3 "Lingual lipase and its role in the digestion of dietary lipid". The Journal of Clinical Investigation. 52 (1): 88—95. January 1973. doi:10.1172/JCI107177. PMID 4682389.
- ↑ 1 2 3 Ross W. Shepherd. Cystic fibrosis : nutritional and intestinal disorders. — Boca Raton, Fla.: CRC Press, 1989. — 169 pages с. — ISBN 0-8493-6954-1, 978-0-8493-6954-4.
- ↑ "The receptors and cells for mammalian taste". Nature. 444 (7117): 288—94. November 2006. doi:10.1038/nature05401. PMID 17108952.
- ↑ 1 2 "Lingual lipase in cystic fibrosis. Quantitation of enzyme activity in the upper small intestine of patients with exocrine pancreatic insufficiency". The Journal of Clinical Investigation. 73 (2): 374—82. February 1984. doi:10.1172/JCI111222. PMID 6699170.
- ↑ "Purification of lingual amylase from serous glands of rat tongue and characterization of rat lingual amylase and lingual lipase". Journal of Dental Research. 68 (2): 139—45. February 1989. doi:10.1177/00220345890680020801. PMID 2465330.