
Ферме́нты, или энзи́мы , — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.

Ци́кл трикарбо́новых кисло́т (сокр. ЦТК, цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные остатки (СН3СО-) окисляются до диоксида углерода (CO2). При этом за один цикл образуется 2 молекулы CO2, 3 НАДН, 1 ФАДH2 и 1 ГТФ (или АТФ). Электроны, находящиеся на НАДН и ФАДH2, в дальнейшем переносятся на дыхательную цепь, где в ходе реакций окислительного фосфорилирования образуется АТФ.
Трансфера́зы (КФ2) — отдельный класс ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот.

Митохо́ндрия — двумембранная сферическая или эллипсоидная органелла диаметром обычно около 1 микрометра. Характерна для большинства эукариотических клеток, как автотрофов, так и гетеротрофов. Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза АТФ и термогенеза. Эти три процесса осуществляются за счёт движения электронов по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют. В специализированных клетках органов животных содержатся сотни и даже тысячи митохондрий.

Циклический аденозинмонофосфат — органическое соединение, производное АТФ, выполняющее в организме роль вторичного посредника, использующегося для внутриклеточного распространения сигналов некоторых гормонов, которые не могут проходить через клеточную мембрану.
Тромбин (фактор свёртывания IIа) — сериновая протеаза, важнейший компонент системы свёртывания крови человека и животных. Тромбин относится к ферментам класса гидролаз, ген F2, кодирующий данный фермент, локализован на коротком плече (p-плечо) 11-ой хромосомы человека. Катализирует гидролиз пептидных связей, образованных остатками аргинина и лизина, обладает ограниченной субстратной специфичностью. Главная его функция — превращение фибриногена в фибрин. Он действует также на несколько других факторов свертывания.
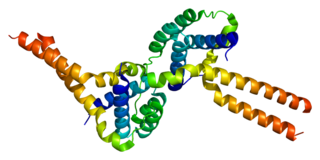
PAFAH1B1 (LIS1), — ген человека, кодирующий некаталитическую альфа-субъединицу внутриклеточной 1b-изоформы ацетилгидролазы тромбоцит-активирующего фактора. Эта гидролаза представляет собой гетеротримерный фермент, специфически катализирующий удаление ацетильной группы тромбоцит-активирующего фактора в позиции SN-2. Мутации, вызывающие повреждение или потерю гена, вызывают лиссенцефалию, ассоциированную с синдромом Миллера-Дикера. Существуют ещё две изоформы фермента: одна состоит из множества субъединиц, другая — из одной субъединицы; к тому же в сыворотке обнаружена ещё одна односоставная изоформа. В одном исследовании показано взаимодействие PAFAH1B1 с рилиновым рецептором VLDLR.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот, имеющих гидроксильные группы или гетероциклической аминогруппы гистидина.
Протеинкиназа А, также цАМФ-зависимая протеинкиназа — протеинкиназа, активность которой зависит от уровня цАМФ в клетке. Протеинкиназа А осуществляет активацию и инактивацию ферментов и других белков за счёт фосфорилирования.
Лизофосфатидилхолинацилтрансфераза (LPCAT) — фермент ацилтрансфераза, переносящий ацильную группу на лизофосфатидилхолин и образуя, таким образом, фосфатидилхолин.
Фактор активации тромбоцитов — сильный фосфолипидный медиатор воспаления. Синтезируется многими типами клеток: нейтрофилами, базофилами, тромбоцитами и эндотелиальными клетками. Участвует в воспалении, агрегации тромбоцитов, играет роль в патогенезе анафилактического шока.
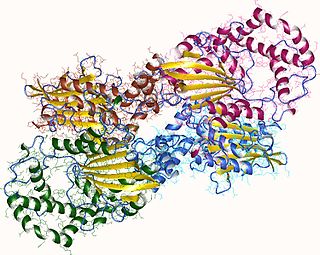
Кислые фосфатазы — ферменты, катализирующие отщепление фосфатных групп от молекул. Отличаются от щелочных фосфатаз оптимальными уровнями pH и рядом других свойств.

Цитратсинтаза — фермент, катализирующий реакцию конденсации ацетата (ацетил-CoA) и оксалоацетата, в результате чего образуется цитрат. Синтетаза цитрата обнаружена практически во всех клетках аэробных организмов, катализируемая реакция является лимитирующей на первом этапе цикла трикарбоновых кислот.

Липопротеин-ассоциированная фосфолипаза А2 (Лп-ФЛА2), также известная как ацетилгидролаза фактора активации тромбоцитов, является ферментом Фосфолипазы А2, которая у человека кодируется геном PLA2G7. Лп-ФЛА2 - это белок с молекулярной массой 45кДа, состоящий из 441 аминокислоты.

Cdk-активи́рующая кина́за — фермент подкласса протеинкиназ, активирующий циклин-зависимую киназу (Cdk) путём фосфорилирования аминокислотного остатка треонина в каталитической области циклин-зависимой киназы. Одной из основных функций CAK-киназы является участие в активации Cdk, и, как следствие, участие в регуляции клеточного цикла. Ещё одна значимая функция CAK-киназы — участие в генной транскрипции.

Белок фосфатазы 2 (PP2) , также известный как PP2A — фермент, кодируемый у человека геном PPP2CA. PP2A — гетеротримерная протеинфосфатаза, являющаяся убиквитарной и консервативной серин/треонин фосфатазой с широкой субстратной специфичностью и разнообразными клеточными функциями. Целями PP2A являются белки онкогенных сигнальных каскадов, такие как Raf, MEK, и AKT.
Thorarchaeota (лат.) — предполагаемый тип архей, выделение которого было предложено в 2016 году на основании метагеномного анализа донных осадков из эстуарной зоны реки White Oak River в Северной Каролине (США). Представители группы способны выделять ацетат при деградации белков и, по-видимому, восстанавливать элементарную серу и тиосульфат. Филогенетический анализ указывает на древность и широкое распространение архей типа. Название группы отражает близость её к другой древней группе архей — Lokiarchaeota.

Треониндезаминаза, также треонин аммиак-лиаза или треониндегидратаза — фермент (КФ 4.3.1.19) из семейства дезаминаз (класс лиазы), катализирующий реакцию дезаминирования L-формы треонина (с образованием α-кетобутирата и аммиака). α-Кетобутират затем может быть трансформирован в L-изолейцин. Для функционирования треониндезаминазы необходима активная форма витамина B6 — кофермент пиридоксальфосфат (PLP). Фермент регулируется аллостерически. Треониндезаминаза обнаружена у бактерий, дрожжей и растений, но отсутствует у животных. Именно из-за отсутствия треониндезаминазы изолейцин является незаменимой аминокислотой для человека и других животных.

Протеинфосфатаза 1 принадлежит к классу белковых серин/треониновых фосфатаз. Было обнаружено, что PP1 важна для контроля метаболизма гликогена, сокращения мышц, клеточного развития, нейрональной активности, сплайсинга РНК, митоза, деления клеток, апоптоза, синтеза белка и регуляции мембранных рецепторов и каналов.
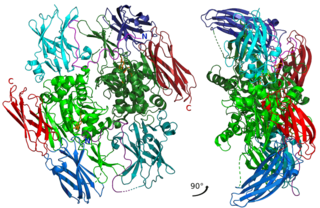
Фактор свёртывания крови XIII, протрансглутаминаза, также фибрин-стабилизирующий фактор или фактор Лаки-Лоранда — представляет собой белок зимоген, обнаруженный в крови человека и некоторых других животных. Он активируется тромбином, путём частичного протеолиза молекул зимогена до фактора XIIIa или трансглутаминазу. Фактор XIIIa представляет собой фермент системы свёртывания крови, сшивающий растворимые молекулы фибрина-мономера, превращая его в более прочную и нерастворимую форму — фибрин-полимер. Дефицит фактора XIII ухудшает стабильность сгустка и увеличивает склонность к кровотечениям. Впервые обнаружен в 1948 году венгерскими биохимиками, изучавшими процесс коагуляции крови — Калманом Лаки и Лазло Лорандом.












