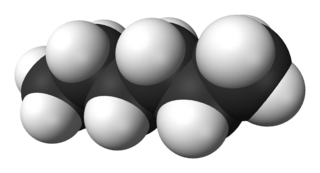
2-Метилпентан
| 2-Метилпентан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | 2-метилпентан | ||
| Традиционные названия | изогексан[1], диметилпропилметан | ||
| Хим. формула | |||
| Рац. формула | |||
| Физические свойства | |||
| Состояние | бесцветная жидкость со слабым запахом бензина | ||
| Молярная масса | 86,1754±0,0058 г/моль | ||
| Плотность | 0,65 г/см3[2] | ||
| Энергия ионизации | 10,12 эВ[7] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -153,68[2] | ||
| • кипения | 60,28 °C | ||
| • вспышки | −32 °C | ||
| • воспламенения | -22[3] °C | ||
| • самовоспламенения | 264 °C по другим данным 240 °C | ||
| Пределы взрываемости | от 1,0 до 7[4] % | ||
| Критическая точка | 3,032 ГПа, 224,55 °C | ||
| Энтальпия | |||
| • образования | 0,1743 кДж/моль | ||
| Давление пара | |||
| Химические свойства | |||
| Растворимость | |||
| • в воде | очень плохая, 0,014 г/л (при 25 °C)[2] | ||
| Оптические свойства | |||
| Показатель преломления | 1,3715 (при 20 °C, 589 нм)[5] | ||
| Классификация | |||
| Рег. номер CAS | 107-83-5 | ||
| PubChem | 7892 | ||
| Рег. номер EINECS | 203-523-4 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 88374 | ||
| Номер ООН | 1208 | ||
| ChemSpider | 7604 | ||
| Безопасность | |||
| Предельная концентрация | 300 мг/м3 | ||
| Краткие характер. опасности (H) | H225, H302, H315, H336, H411[6] | ||
| Меры предостор. (P) | P210, P261, P273, P301, + P310, P331[2] | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
2-Метилпента́н, изогекса́н, диметилпропилмета́н — химическое органическое соединение из группы алифатических предельных углеводородов, один из изомеров гексана.
Нахождение в природе
2-метилпентан в заметных количествах присутствует в нефти.
Получение
Соединение может быть получено каталитической изомеризацией из н-гексана[8].
Химические свойства
По химическим свойствам 2-метилпентан является типичным предельным углеводородом, для него характерны такие реакции, как сульфоокисление, сульфохлорирование, галогенирование, нитрование, дегидрирование в присутствии катализаторов и окисление (горение).
Присоединение радикалов легче происходит в положении 2, так, при нитровании, галогенировании в основном получаются 2-метил-2-нитропентан, или, в случае бромирования 2-метил-2-бромпентан, но при этих реакциях также образуется смесь других изомеров с разной степенью замещения атомов водорода.
На никелевом катализаторе при нагреве возможна реакция дегидроциклизации с образованием метилциклопентана.
Уравнение полного окисления 2-метилпентана кислородом:
- .
Физические свойства
2-Метилпентан — легковоспламеняющаяся, летучая, бесцветная жидкость со слабым специфическим запахом бензина[2].
Согласно уравнению Антуана давление насыщенного пара вещества может быть вычислено по формуле,
Приведённая формула даёт хорошую точность в диапазоне температур от 286 до 334 К[9].
Температурную зависимость теплоты парообразования в диапазоне температур от 298 K до 333 K можно рассчитать по уравнению[10]:
- где выражена в кДж/моль,
- — приведённая температура,
- кДж/моль, и К.
Октановое число 2-метилпентана 66[4].
Хроматографический индекс удерживания Ковача 569,5 (при 35 °С)[11].


Термодинамические свойства
Наиболее важные термодинамические свойства перечислены в таблице:
| Свойство | Обозначение | Значение |
|---|---|---|
| Энтальпия образования | −174,3 кДж/моль[10] | |
| Теплота сгорания | −4157,7 кДж/моль[10] | |
| Теплоёмкость | 194,19 Дж/(моль·K) (25 °C)[12] (жидкость) | |
| Удельная теплота плавления | 6,27 кДж/моль[13] (при температуре плавления) | |
| Удельная теплота испарения | 53,43 кДж/моль[13] (при температуре кипения) | |
| Теплота кипения | 27,79 кДж/моль[14] (при температуре кипения и при нормальном давлении) 30,1 кДж/моль[14] (при 25 °C) | |
| Критическая температура | 224,5 °C[15] | |
| Критическое давление | 30,4 бар[15] | |
| Критический объём | 0,368 л/моль[15] | |
| Критическая плотность | 2,72 моль/л[15] |
Применение
2-метилпентан используется в качестве растворителя и содержится в чистящих средствах[2].
Соединение также используется в качестве эталонного вещества в cпектроскопии и хроматографии[8].
Физиологическое действие
2-Метилпентан обладает наркотическим и общеядовитым действием[16]. По степени воздействия на организм он относится к токсичным малоопасным веществам (4-го класса опасности)[17]. ПДК для промышленных помещений составляет 300 мг/м3 (для близкого по физиологическому действию вещества — н-гексана)[3]. При длительном вдыхании паров вещества возможно наркотическое опьянение, раздражение глаз, сонливость, угнетение центральной нервной системы. Хроническое отравление может вызвать паралич конечностей.
По нормам ACGIH среднесменная предельная концентрация 0,05 об. % или 1760 мг/м3. Максимальная разовая концентрация: при воздействии не более 15 минут, не чаще 4 раз в смену: 0,1 об. % или 3500 мг/м3(ACGIH 1993—1994)[11].
Опасность
Жидкость пожароопасная и легко воспламеняемая. Пары вещества тяжелее воздуха и стелются по нижней части помещений.
Смесь паров с воздухом взрывоопасна, концентрационные пределы взрываемости от 1 до 7 об. %. Температура вспышки -22 °C, температура самовоспламенения: 240 °C[3].
Примечания
- ↑ Haynes William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida: CRC Press. p. 3—364. ISBN 978-1439820773.
- ↑ 1 2 3 4 5 6 7 8 9 10 Record of 2-Methylpentan in the GESTIS Substance Database of the IFA.
- ↑ 1 2 3 Российские нормативы на н-гексан: максимально разовая ПДК в воздухе рабочей зоны 300 мг/м3. Класс опасности: 4 (1998).
- ↑ 1 2 2-Метилпентан
- ↑ Datenblatt 2-Methylpentane (PDF) bei Merck, abgerufen am 8. Oktober 2010.
- ↑ name=www.ilo.org_Isohexane
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 Eintrag zu Methylpentane (нем.). In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
- ↑ Williamham C. B.; Taylor W. J.; Pignocco J. M.; Rossini F. D. Vapor Pressures and Boiling Points of Some Paraffin, Alkylcyclopentane, Alkylcyclohexane, and Alkylbenzene Hydrocarbons in J. Res. Natl. Bur. Stand. (U.S.) 35 (1945) 219—244.
- ↑ 1 2 3 Prosen E. J.; Rossini F. D.: Heats of combustion and formation of the paraffin hydrocarbons at 25 °C in: J. Res. Natl. Bur. Stand. (U.S.) 35 (1945) 263—267.
- ↑ 1 2 2-Метилпентан
- ↑ Ohnishi K.; Fujihara I.; Murakami S.: Thermodynamic properties of decalins mixed with hexane isomers at 298.15K. 1. Excess enthalpies and excess isobaric heat capacities in Fluid Phase Equilib. 46 (1989) 59-72, doi:10.1016/0378-3812(89)80275-4.
- ↑ 1 2 Douslin D. R.; Huffman H. M.: Low-temperature thermal data on the five isometric hexanes in J. Am. Chem. Soc. 68 (1946) 1704—1708, doi:10.1021/ja01213a006.
- ↑ 1 2 Majer, V.; Svoboda, V.: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- ↑ 1 2 3 4 Daubert T. E.: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes in J. Chem. Eng. Data 41 (1996) 365—372, doi:10.1021/je9501548.
- ↑ Алканы. (недоступная ссылка)
- ↑ 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности. (недоступная ссылка)
См. также
Литература
- CRC Handbook of Chemistry and Physics. — 95 ed. — CRC Press, 2014. — P. 3—384.
- Seidell A. Solubilities of organic compounds. — 3ed., vol. 2. — New York: D. Van Nostrand Company, 1941. — P. 459—460.
- Yalkowsky S. H., Yan H. Handbook of aqueous solubility data. — CRC Press, 2003. — P. 322.
- Оболенцев Р. Д. Физические константы углеводородов жидких топлив и масел. — 2 изд. — М.—Л.: ГНТИНГТЛ, 1953. — С. 8—9.
- Свойства органических соединений: Справочник. — Под ред. Потехина А. А. — Л.: Химия, 1984. — С. 266—267.
- Справочник химика. — Т. 2. — Л.—М.: Химия, 1964. — С. 864—865.
- Физико-химические свойства индивидуальных углеводородов. — М.: ГНТИНГТЛ, 1960. — С. 22—23.