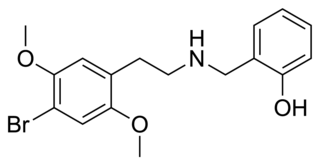
25B-NBOMe
| 25B-NBOMe | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | 2-(4-бром-2,5-диметоксифенил)-N-[(2-метоксифенил)метил]этанамин |
| Хим. формула | C18H22BrNO3 |
| Физические свойства | |
| Молярная масса | 380.275 г/моль |
| Классификация | |
| Рег. номер CAS | 1026511-90-9 |
| PubChem | 9977044 |
| SMILES | |
| InChI | |
| ChemSpider | 8152636 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
25B-NBOMe (NBOMe-2C-B, Cimbi-36, Nova, BOM 2-CB) — психоактивное вещество из класса фенилэтиламинов, производное от 2C-B, разработанное в 2004 году Ральфом Хеймом в Свободном университете Берлина. Он действует как мощный частичный агонист человеческого рецептора 5-HT2A.[1][2][3][4] Несистематические сообщения от потребителей предполагают, что 25B-NBOMe является активным галлюциногеном в дозе всего лишь 250—500 мкг, что делает его аналогичным по эффективности для других галлюциногенов, полученных из фенилэтиламина, таких как Bromo-DragonFLY. Продолжительность эффекта длится около 12—16 часов.
Использование в качестве радиоактивного индикатора
Меченый carbon-11 вариант этого соединения ([11C]Cimbi-36) был синтезирован и подтверждён как радиоактивный индикатор для позитронно-эмиссионной томографии (ПЭТ) в Копенгагене.[5][6][7] В качестве 5-HT2A-рецепторного агониста РЕТ-радиолиганда [11C]Cimbi-36 предположили, что он обеспечивает более функциональный маркер этих рецепторов. Кроме того, [11C]Cimbi-36 исследуется как потенциальный маркер выделения серотонина и, таким образом, может служить индикатором уровня серотонина в естественных условиях. [11C]Cimbi-36 в настоящее время проходит клинические испытания в качестве ПЭТ-лиганда у людей.
Токсичность
25B-NBOMe используется в клинических испытаниях с оценочной дозой для обеспечения безопасности для людей только 1 мкг. Такая доза составляет только 1/300-й дозы, которая, как ожидается, будет галлюциногенна для человека, и ожидается, что рекреационное использование значительно превысит дозы, которые, как полагают, являются безопасными для людей.[8] Сообщается об одном случае, когда 25B-NBOMe был идентифицирован как причина смерти для 17-летнего мальчика.[9] Несколько смертей были приписаны его близкому аналогу 25I-NBOMe.
Правовой статус

Канада
По состоянию на 31 октября 2016 года; 25B-NBOMe — это контролируемое вещество (Список III) в Канаде.[10]
Россия
Запрещено как производное от 2-Амино-1-(4-бром-2,5-диметоксифенил) этанона постановлением от 5 мая 2015 года.[11]
США
В ноябре 2013 года УБН временно разместило 25B-NBOMe (вместе с 25I-NBOMe и 25C-NBOMe) в Список I Закона о контролируемых веществах, что делает его незаконным веществом в течение двух лет.[12] В ноябре 2015 года временное размещение было продлено ещё на один год.[13]
См. также
Примечания
- ↑ Ralf Heim. Synthese und Pharmakologie potenter 5-HT2A-Rezeptoragonisten mit N-2-Methoxybenzyl-Partialstruktur. Entwicklung eines neuen Struktur-Wirkungskonzepts. (нем.). diss.fu-berlin.de (28 февраля 2010). Дата обращения: 10 мая 2013. Архивировано 16 апреля 2012 года.
- ↑ Maria Silva PhD. Theoretical study of the interaction of agonists with the 5-HT2A receptor. Архивная копия от 24 июля 2017 на Wayback Machine Universität Regensburg, 2009.
- ↑ Silva M.E., Heim R., Strasser A., Elz S., Dove S. Theoretical studies on the interaction of partial agonists with the 5-HT(2A) receptor (англ.) // Journal of Computer-aided Molecular Design : journal. — 2011. — January (vol. 25, no. 1). — P. 51—66. — doi:10.1007/s10822-010-9400-2. — PMID 21088982.
- ↑ Hansen, M.; Phonekeo, K.; Paine, J. S.; Leth-Petersen, S.; Begtrup, M.; Bräuner-Osborne, H.; Kristensen, J. L. Synthesis and Structure-Activity Relationships of N-Benzyl Phenethylamines as 5-HT2A/2C Agonists (англ.) // ACS Chemical Neuroscience[англ.] : journal. — 2014. — Vol. 5, no. 3. — P. 243—249. — doi:10.1021/cn400216u. — PMID 24397362. — PMC 3963123.
- ↑ Hansen, M. (2011). Design and Synthesis of Selective Serotonin Receptor Agonists for Positron Emission Tomography Imaging of the Brain. Архивная копия от 22 октября 2013 на Wayback Machine PhD Thesis, University of Copenhagen.
- ↑ Ettrup, A.; Hansen, M.; Santini, M. A.; Paine, J.; Gillings, N.; Palner, M.; Lehel, S.; Herth, M. M.; Madsen, J.; Kristensen, J.; Begtrup, M.; Knudsen, G. M. Radiosynthesis and in vivo evaluation of a series of substituted 11C-phenethylamines as 5-HT2A agonist PET tracers (англ.) // European Journal of Nuclear Medicine and Molecular Imaging[англ.] : journal. — 2010. — Vol. 38, no. 4. — P. 681—693. — doi:10.1007/s00259-010-1686-8. — PMID 21174090.
- ↑ Ettrup, A.; Holm, S. R.; Hansen, M.; Wasim, M.; Santini, M. A.; Palner, M.; Madsen, J.; Svarer, C.; Kristensen, J. L.; Knudsen, G. M. Preclinical Safety Assessment of the 5-HT2A Receptor Agonist PET Radioligand \11C]Cimbi-36 (англ.) // Molecular Imaging and Biology[англ.] : journal. — 2013. — Vol. 15, no. 4. — P. 376—383. — doi:10.1007/s11307-012-0609-4. — PMID 23306971.
- ↑ Preclinical Safety Assessment of the 5-HT2A Receptor Agonist PET Radioligand [11C]Cimbi-36 (недоступная ссылка)
- ↑ Roxas, Gabriel (2015-02-19). "Designer Drug Identified As Cause Of Plano Teen's Death". CBS 11 News. Архивировано 1 декабря 2017. Дата обращения: 22 февраля 2015.
{{cite news}}: Указан более чем один параметр|accessdate=and|access-date=() - ↑ Canada Gazette – Regulations Amending the Food and Drug Regulations (Part J — 2C-phenethylamines). Дата обращения: 24 июня 2017. Архивировано 31 августа 2016 года.
- ↑ Постановление Правительства РФ от 30.06.1998 № 681 "Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федер... Дата обращения: 24 июня 2017. Архивировано 19 апреля 2013 года.
- ↑ Three More Synthetic Drugs Become Illegal For At Least Two Years. Дата обращения: 24 июня 2017. Архивировано 4 ноября 2014 года.
- ↑ Drug Enforcement Administration. Schedules of Controlled Substances: Extension of Temporary Placement of Three Synthetic Phenethylamines in Schedule I. Final order (англ.) // Fed Regist. : journal. — 2015. — Vol. 80, no. 219. — P. 70657—70659. — PMID 26567439.