Рибонуклеи́новая кислота́ (РНК) — одна из трёх основных макромолекул, которые содержатся в клетках всех живых организмов и играют важную роль в кодировании, прочтении, регуляции и экспрессии генов.

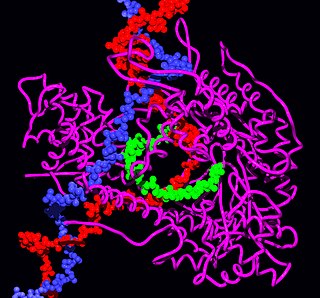
Рибосо́ма — важнейшая немембранная органелла всех живых клеток, служащая для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц. Малая субъединица считывает информацию с матричной РНК, а большая — присоединяет соответствующую аминокислоту к синтезируемой цепочке белка.

Транспортная РНК, тРНК — рибонуклеиновая кислота, обеспечивающая взаимодействие аминокислоты, рибосомы и матричной РНК (мРНК) в ходе трансляции. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК, будучи ковалентно связаны с остатком аминокислоты, принимает непосредственное участие в наращивании полипептидной цепи, специфически присоединяясь к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса.
Промо́тор — последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала транскрипции. Промотор играет одну из ключевых ролей в процессе инициации транскрипции.
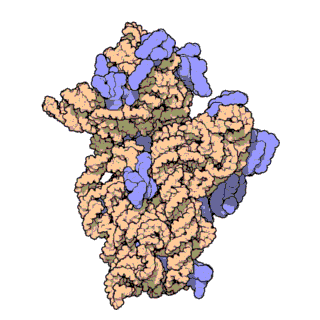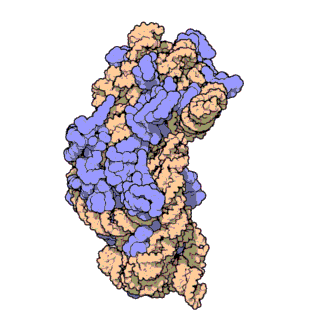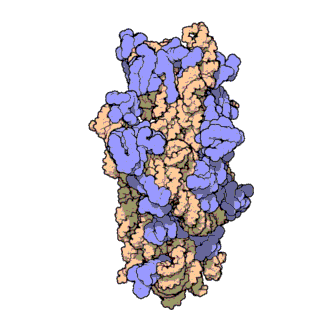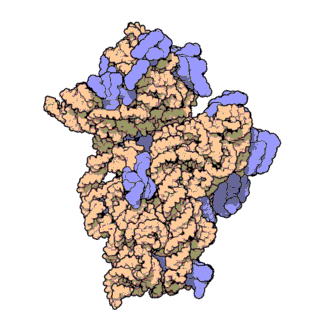
16S рРНК — один из трёх основных типов рРНК, образующих основу рибосом прокариот. Цифры в названии рРНК равны значению константы седиментации. Соответственно, для данной молекулы это значение равно 16S. Всего в прокариотических микроорганизмах обнаружено три типа рРНК: 23S и 5S в большой субъединице рибосомы (50S), 16S в малой субъединице рибосомы (30S). Аналогично, константы двух других молекул рРНК равны 23 и 5 S соответственно. Эукариотическим аналогом 16S рРНК является 18S рРНК.
Интроны — участки ДНК, копии которых удаляются из первичного транскрипта и отсутствуют в зрелой РНК.
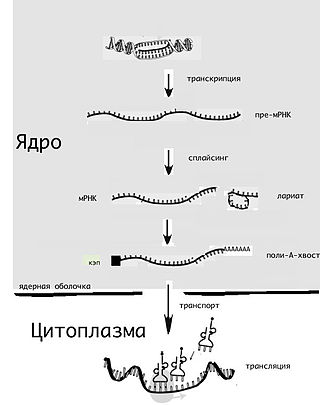
Ма́тричная рибонуклеи́новая кислота́ — РНК, содержащая информацию о первичной структуре белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Консе́нсусная после́довательность Ко́зак — последовательность нуклеотидов в составе молекулы мРНК эукариот, окружающая старт-кодон и важная для инициации трансляции. Консенсусная последовательность была впервые описана Мэрилин Козак в 1986 году.
Полиаденили́рование — это процесс присоединения большого количества остатков аденозинмонофосфата к 3'-концу первичной мРНК (пре-мРНК). Иными словами, поли(А)-хвост — это фрагмент молекулы мРНК, азотистые основания которого представлены только аденином. У эукариот полиаденилирование является частью процессинга мРНК — процесса созревания первичного транскрипта в зрелую мРНК, готовую для трансляции. Процессинг, в свою очередь, является одним из этапов экспрессии генов.

Редакти́рование РНК — процесс, в ходе которого нуклеотиды в новосинтезированной РНК подвергаются химическим модификациям. Редактирование РНК также может включать вставку, делецию или замену нуклеотидов в молекуле РНК. Редактирование РНК — довольно редкий процесс, и типичные этапы процессинга мРНК обычно не рассматриваются как редактирование.

G-квадру́плексы (англ. G-quadruplex, а также G-tetrads или G4) — последовательности нуклеиновых кислот, обогащенные гуанином и способные образовывать структуры из четырёх цепей. Цепи нуклеиновых кислот из гуанозиновых олиго- и полинуклеотидов способны связываться друг с другом при наличии моновалентного катиона небольшого размера, чаще всего — калия. С помощью дифракционного анализа было показано, что такие поли(G)-нити представляют собой новый тип укладки ДНК, четырёхцепочечную спираль, где четыре гуаниновых основания из разных цепей образуют плоскую структуру, удерживаемую парными взаимодействиями G-G (рис. 1). Такие структуры отличаются высокой стабильностью в растворе и называются гуаниновыми (G)-квартетами, или G-тетрадами. Каждый G-квартет скреплен в сумме восемью водородными связями, образованными взаимодействием Уотсон-Криковской стороны одного гуанинового основания с Хугстиновской стороной другого. G-квадруплексы могут быть также образованы короткими олигонуклеотидами с соответствующей последовательностью, которую можно схематически записать как GmXnGmXoGmXpGm, где m — количество гуанинов в G-блоке. Эти гуанины обычно непосредственно задействованы в образовании G-тетрад. Xn, Xo и Xp могут быть комбинацией любых остатков, включая G; такие участки формируют петли между G-тетрадами.
Моти́в в молекулярной биологии — относительно короткая последовательность нуклеотидов или аминокислот, слабо меняющаяся в процессе эволюции и, по крайней мере предположительно, имеющая определённую биологическую функцию. Под мотивом иногда подразумевают не конкретную последовательность, а каким-либо образом описанный спектр последовательностей, каждая из которых способна выполнять определённую биологическую функцию данного мотива.
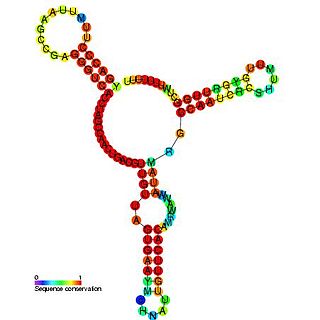
Ма́лые РНК бакте́рий — небольшие некодирующие РНК длиной 50—250 нуклеотидов, содержащиеся в клетках бактерий. Как правило, малые РНК бактерий имеют сложную структуру и содержат несколько шпилек. Многочисленные малые РНК были определены в клетках кишечной палочки, модельном патогене Salmonella, азотфиксирующей альфа-протеобактерии Sinorhizobium meliloti, морских цианобактериях, возбудителе туляремии Francisella tularensis, патогене растений Xanthomonas oryzae pathovar oryzae и других бактериях. Для поиска малых РНК в геноме бактерий использовали компьютерный анализ и различные лабораторные методы.
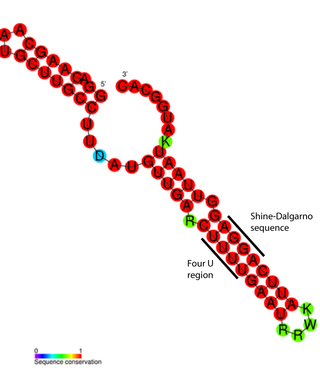
РНК-термо́метр, или РНК-термосе́нсор — температурочувствительная некодирующая РНК, которая принимает участие в регуляции экспрессии генов. РНК-термометры, как правило, регулируют гены, которые необходимы для ответа на тепловой или холодовой шок, однако показано их участие в регуляции длительного голодания и патогенности.

Рибосомная РНК 5,8S — некодирующий компонент РНК большой субъединицы эукариотической рибосомы, играющий важную роль в трансляции белка. Он транскрибируется РНК-полимеразой I как часть предшественника 45S, который также содержит 18S и 28S рРНК. Считается, что его функция заключается в транслокации рибосом. Также известно, что он образует ковалентную связь с белком-супрессором опухоли p53. 5,8S рРНК можно использовать в качестве эталонного гена для обнаружения микроРНК. Рибосомная РНК 5,8S используется для лучшего понимания других процессов и путей рРНК в клетке.

Митохондриальная рибосома, или миторибосома, представляет собой белковый комплекс, активный в митохондриях и функционирующий как рибопротеин для трансляции митохондриальных мРНК, закодированных в мтДНК. Миторибосома прикреплена к внутренней митохондриальной мембране. Миторибосомы, как и цитоплазматические рибосомы, состоят из двух субъединиц — большой (mt-LSU) и малой (mt-SSU). Миторибосомы состоят из нескольких специфических белков и меньшего количества рРНК. В то время как митохондриальные рРНК кодируются в митохондриальном геноме, белки, составляющие миторибосомы, кодируются в ядре и собираются цитоплазматическими рибосомами перед имплантацией в митохондрии.

Переворот оснований ДНК, или переворот нуклеотидов, представляет собой механизм, в котором одиночное основание нуклеотида, или азотистое основание, вращается вне двойной спирали нуклеиновой кислоты. Это происходит, когда ферменту, обрабатывающему нуклеиновую кислоту, требуется доступ к основанию для выполнения работы с ним, например, для его вырезания для замены другим основанием во время репарации ДНК. Впервые он был обнаружен в 1994 году с помощью рентгеновской кристаллографии фермента метилтрансферазы, катализирующего метилирование цитозинового основания в ДНК. С тех пор было показано, что он используется различными ферментами во многих биологических процессах, таких как метилирование ДНК, различные механизмы восстановления ДНК и репликация ДНК. Это также может происходить в двойных спиралях РНК или в интермедиатах «ДНК:РНК», образующихся во время транскрипции РНК.
CRISPR-Cas13 это РНК-нуклеаза которую можно использовать для целенаправленной деградации РНК. Ферменты Cas13 имеют два эндоРНКазных домена HEPN. Для нацеливания этот фермент использует направляющую РНК (gRNA). После активации путем спаривания между последовательностью CRISPR РНК (crРНК) и комплементарной одноцепочечной РНК (ssРНК)-мишенью эффектор Cas13 вызывает расщепление РНК-мишени, При этом для активации рибонуклеазы Cas13 требуется почти идеальная комплементарность между целевой РНК и Cas13-ассоциированной направляющей РНК. Поскольку программируемая последовательность направляющей РНК Cas13 примерно в три раза больше, чем исходная последовательность кшРНК, опосредованный CRISPR-Cas13 сайленсинг транскрипции дает исследователям большую избирательность цели. Еще одним преимуществом является то, что Cas13 не требует последовательности PAM, что теоретически позволяет ему нацеливаться практически на любую область РНК.

Замкнутая нуклеиновая кислота, также известная как мостиковая нуклеиновая кислота (BNA) и часто называемая недоступной РНК, представляет собой модифицированный нуклеотид РНК, в котором фрагмент рибозы модифицирован дополнительным мостиком, соединяющим 2'-кислородную группу. и 4' углерод. Мостик «запирает» рибозу в 3'- эндо (северной) конформации, которая часто встречается в дуплексах А-формы. Эта структура обеспечивает повышенную устойчивость к ферментативному расщеплению. LNA также предлагает повышенную специфичность и аффинность при спаривании оснований в качестве мономера или компонента олигонуклеотида. Нуклеотиды LNA могут быть смешаны с остатками ДНК или РНК в олигонуклеотиде.
Мэрилин С. Козак — американская учёная, профессор биохимии в медицинской школе Роберта Вуда Джонсона. Ранее она работала в Университете медицины и стоматологии Нью-Джерси до его объединения с Ратгерским университетом. Она получила степень доктора микробиологии в Университете Джона Хопкинса, изучая синтез бактериофага MS2 под руководством Даниела Натанса. Изначально, планируя работать на факультете, она собиралась изучать механизм инициации трансляции эукариот — проблему, которая, как долгое время считалось, уже была решена Джоан Стейтц. Работая на факультете биологических наук Питтсбургского университета, она опубликовала серию исследований, в которых была установлена сканирующая модель инициации трансляции и Последовательность Козак. Ее текущие научные интересы неизвестны, поскольку ее последняя публикация была в 2008 году.













