6-фосфоглюконолактоназа
| 6-фосфоглюконолактоназа | |
|---|---|
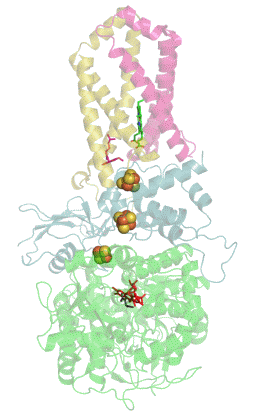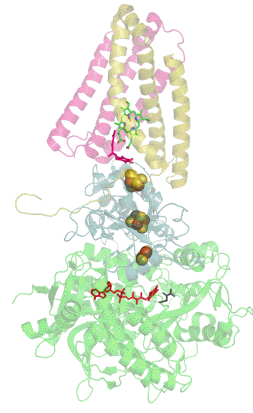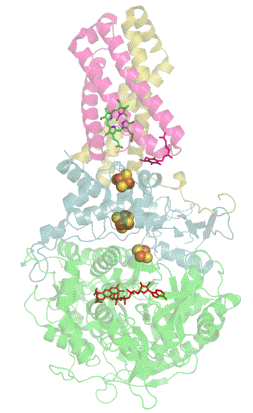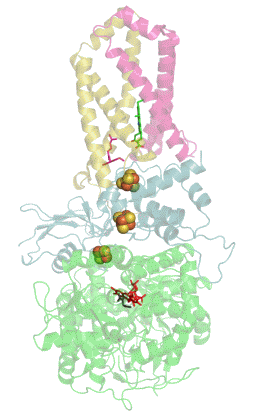
![Кристаллизованный мономер 6-фосфоглюконолактоназы из Trypanosoma brucei, в комплексе с 6-фосфоглюконовой кислотой[1].](https://upload.wikimedia.org/wikipedia/commons/thumb/c/cc/6-phosphogluconolactonase_complexed_with_6-phosphogluconic_acid._PDB-_3E7F.png/220px-6-phosphogluconolactonase_complexed_with_6-phosphogluconic_acid._PDB-_3E7F.png) Кристаллизованный мономер 6-фосфоглюконолактоназы из Trypanosoma brucei, в комплексе с 6-фосфоглюконовой кислотой[1]. | |
| Идентификаторы | |
| Шифр КФ | 3.1.1.31 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
6-Фосфоглюконолактоназа (6PGL, PGLS) — цитозольный фермент, обнаруженный во всех организмах, который катализирует гидролиз 6-фосфоглюконолактона до 6-фосфоглюконовой кислоты в окислительной фазе пентозофосфатного пути[2]. Третичная структура 6PGL использует α/β гидролазную складку с остатками активного сайта, сгруппированными на петлях α-спиралей. Основываясь на кристаллической структуре фермента, предполагается, что механизм зависит от переноса протона остатком гистидина в активном центре. 6PGL избирательно катализирует гидролиз δ-6-фосфоглюконолактона и не проявляет активности в отношении γ-изомера[3].
Механизм действия
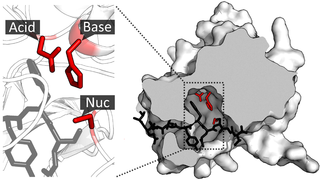
Было предложено, чтобы 6PGL гидролиз 6-фосфоглюконолактона до 6-фосфоглюконовой кислоты протекал через перенос протона к атому кислорода кольца O5[4] аналогично ксилозоизомеразе[5] и рибозо-5-фосфатизомеразе[6]. Реакция инициируется атакой гидроксид- иона на сложный эфир C5. Формируется тетраэдрический промежуточный продукт, и следует отщепление сложноэфирной связи, чему способствует передача протона от остатка гистидина в активном центре. Конкретный остаток, который участвует в переносе протона, ускользал от исследователей до 2009 года, поскольку предыдущие структурные исследования продемонстрировали две возможные конформации субстрата в активном центре, которые располагают кислород кольца O5 проксимальнее остатка аргинина или гистидина. Молекулярно-динамическое моделирование использовалось, чтобы обнаружить, что остаток, который передает протон, представляет собой гистидин, и что остатки аргинина участвуют только в электрической стабилизации отрицательно заряженной фосфатной группы[4]. Электрическая стабилизация комплекса фермент-субстрат также происходит между карбоксилатным продуктом и аминами основной цепи окружающих остатков глицина[4].

Структура фермента
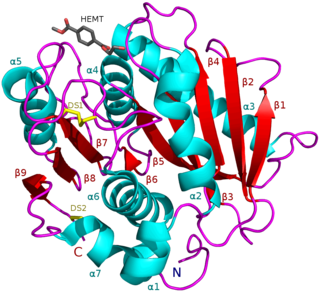
6PGL у Homo sapiens существует как мономер в цитозольных физиологических условиях и состоит из 258 аминокислотных остатков с общей молекулярной массой ~ 30 кДа[7]. Третичная структура фермента использует α/β гидролазную складку с параллельными и антипараллельными β-слоями, окруженными восемью α-спиралями и пятью спиралями 310. Стабильность третичной структуры белка усиливается за счет солевых мостиков между остатками аспарагиновой кислоты и аргинина, а также за счет взаимодействия стэкинга ароматических боковых цепей. Было обнаружено, что 6PGL, выделенный из Trypanosoma brucei, связывается с ионом Zn+2 в некаталитической роли, но этого не наблюдалось у других организмов, включая Thermotoga maritima и Vibrio cholerae.
Биологическая функция
6-фосфоглюконолактоназа катализирует превращение 6-фосфоглюконолактона в 6-фосфоглюконовую кислоту, оба промежуточных продукта в окислительной фазе пентозофосфатного пути, в котором глюкоза превращается в рибулозо-5-фосфат . Окислительная фаза пентозофосфатного пути высвобождает CO2 и приводит к образованию двух эквивалентов НАДФН из НАДФ+. Конечный продукт, рибулозо-5-фосфат, дополнительно обрабатывается организмом во время неокислительной фазы пентозофосфатного пути для синтеза биомолекул, включая нуклеотиды, АТФ и кофермент А[3].
Фермент, который предшествует 6PGL в пентозофосфатном пути, глюкозо-6-фосфатдегидрогеназа, исключительно образует δ-изомер 6-фосфоглюконолактона. Однако, если оно накапливается, это соединение может подвергаться внутримолекулярной перегруппировке с изомеризацией до более стабильной γ-формы, которая не может гидролизоваться 6PGL и не может переходить в неокислительную фазу пентозофосфатного пути. Благодаря быстрому гидролизу δ-изомера 6-фосфоглюконолактона 6PGL предотвращает его накопление и последующее образование γ-изомера, что приводит к неэффективной трате ресурсов глюкозы, доступных клетке[3] 6-фосфоглюконолактон также подвержен атаке со стороны внутриклеточных нуклеофилов, о чём свидетельствует α-N-6-фосфоглюконоилирование белков, меченных His, экспрессируемых в E.coli[8][9], и эффективный гидролиз 6-фосфоглюконолактона 6PGL. предотвращает накопление лактона и последующие токсические реакции между промежуточным лактоном и клеткой[3].
Актуальность болезни
Было показано, что малярийные паразиты Plasmodium berghei и Plasmodium falciparum экспрессируют бифункциональный фермент, который проявляет активность как глюкозо-6-фосфатдегидрогеназы, так и 6-фосфоглюконолактоназы, что позволяет им катализировать первые две стадии пентозофосфатного пути[10]. Этот бифункциональный фермент был идентифицирован как лекарственная мишень для малярийных паразитов[11] и высокопроизводительный скрининг низкомолекулярных ингибиторов привел к открытию новых соединений, которые потенциально могут быть переведены в мощные противомалярийные средства[12][13].
Примечания
- ↑ Delarue M, Duclert-Savatier N, Miclet E, Haouz A, Giganti D, Ouazzani J, Lopez P, Nilges M, Stoven V (February 2007). "Three dimensional structure and implications for the catalytic mechanism of 6-phosphogluconolactonase from Trypanosoma brucei". Journal of Molecular Biology. 366 (3): 868—81. doi:10.1016/j.jmb.2006.11.063. PMID 17196981.
- ↑ Jeremy M. Berg. Biochemistry. — 7th ed. — New York: W.H. Freeman, 2012. — xxxii, 1054, 43, 41, 48 pages с. — ISBN 978-1-4292-2936-4, 1-4292-2936-5, 978-1-4292-7635-1, 1-4292-7635-5, 978-1-4292-7396-1, 1-4292-7396-8.
- ↑ 1 2 3 4 "NMR spectroscopic analysis of the first two steps of the pentose-phosphate pathway elucidates the role of 6-phosphogluconolactonase". The Journal of Biological Chemistry. 276 (37): 34840—6. September 2001. doi:10.1074/jbc.M105174200. PMID 11457850.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 3 "Insights into the enzymatic mechanism of 6-phosphogluconolactonase from Trypanosoma brucei using structural data and molecular dynamics simulation". Journal of Molecular Biology. 388 (5): 1009—21. May 2009. doi:10.1016/j.jmb.2009.03.063. PMID 19345229.
- ↑ "A metal-mediated hydride shift mechanism for xylose isomerase based on the 1.6 A Streptomyces rubiginosus structures with xylitol and D-xylose". Proteins. 9 (3): 153—73. 1991-03-01. doi:10.1002/prot.340090302. PMID 2006134.
- ↑ "Structure of Escherichia coli ribose-5-phosphate isomerase: a ubiquitous enzyme of the pentose phosphate pathway and the Calvin cycle". Structure. 11 (1): 31—42. January 2003. doi:10.1016/S0969-2126(02)00933-4. PMID 12517338.
- ↑ "Identification of the cDNA encoding human 6-phosphogluconolactonase, the enzyme catalyzing the second step of the pentose phosphate pathway(1)". FEBS Letters. 459 (2): 223—6. October 1999. doi:10.1016/S0014-5793(99)01247-8. PMID 10518023.
- ↑ "Spontaneous alpha-N-6-phosphogluconoylation of a "His tag" in Escherichia coli: the cause of extra mass of 258 or 178 Da in fusion proteins". Analytical Biochemistry. 267 (1): 169—84. February 1999. doi:10.1006/abio.1998.2990. PMID 9918669.
- ↑ "Post-translational modification of the N-terminal His tag interferes with the crystallization of the wild-type and mutant SH3 domains from chicken src tyrosine kinase". Acta Crystallographica Section D. 57 (Pt 5): 759—62. May 2001. doi:10.1107/s0907444901002918. PMID 11320329.
- ↑ "Glucose-6-phosphate dehydrogenase-6-phosphogluconolactonase. A novel bifunctional enzyme in malaria parasites". European Journal of Biochemistry. 268 (7): 2013—9. April 2001. doi:10.1046/j.1432-1327.2001.02078.x. PMID 11277923.
- ↑ "Plasmodium falciparum glucose-6-phosphate dehydrogenase 6-phosphogluconolactonase is a potential drug target". The FEBS Journal. 282 (19): 3808—23. October 2015. doi:10.1111/febs.13380. PMID 26198663.
- ↑ "High-throughput screening for small-molecule inhibitors of plasmodium falciparum glucose-6-phosphate dehydrogenase 6-phosphogluconolactonase". Journal of Biomolecular Screening. 17 (6): 738—51. July 2012. doi:10.1177/1087057112442382. PMID 22496096.
- ↑ "Discovery of a Plasmodium falciparum glucose-6-phosphate dehydrogenase 6-phosphogluconolactonase inhibitor (R,Z)-N-((1-ethylpyrrolidin-2-yl)methyl)-2-(2-fluorobenzylidene)-3-oxo-3,4-dihydro-2H-benzo[b][1,4]thiazine-6-carboxamide (ML276) that reduces parasite growth in vitro". Journal of Medicinal Chemistry (англ.). 55 (16): 7262—72. August 2012. doi:10.1021/jm300833h. PMID 22813531.
Ссылки
- MeSH 6-phosphogluconolactonase
- "Identification of the cDNA encoding human 6-phosphogluconolactonase, the enzyme catalyzing the second step of the pentose phosphate pathway(1)". FEBS Letters. 459 (2): 223—6. October 1999. doi:10.1016/S0014-5793(99)01247-8. PMID 10518023.