ABCA4
Член 4 подсемейства A (АВС1) ATP-связывающей кассеты, также известный как ABCA4 или ABCR — белок, который в организме человека кодируется геном ABCA4.[1][2][3]
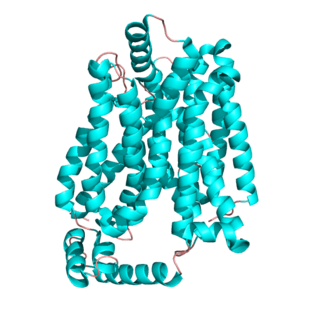
ABCA4 — это член семейства АТФ-связывающего кассетного транспортера[англ.], подсемейства A (АВС1), обнаруженного исключительно у многоклеточных эукариот[1]. Ген изолирован и охарактеризован в 1997 году как ген, который вызывает болезнь Штаргардта, аутосомно-рецессивные заболевания, порождающие дегенерацию жёлтого пятна[4]. Ген ABCA4 транскрибирует большой ретино-специфический белок с двумя трансмембранными доменами (TMD), двумя гликозилированными внеклеточными доменами (ECD), и двумя нуклеотидосвязывающими доменами (NBD). Белок ABCA4 почти исключительно выражен в сетчатке, локализуясь в наружном сегменте диска фоторецепторов[5].
Структура
Недавно предложенная структура ABCA4 предполагает наличие трансмембранных доменов (TMDS), двух больших гликозилированных внеклеточных доменов (ECD), и двух внутренних нуклеотидосвязывающих доменов (NBD). Один Трансмембранный домен пересекает мембрану вместе с шестью единицами белка, связанных друг с другом с образованием домена. Трансмембранные домены, как правило, не консервативны из-за своей специфики и разнообразия функций в качестве каналов или лигандсвязывающих контроллеров. Тем не менее, нуклеотидсвязывающий домен высоко консервативны в разных геномах — наблюдается постоянство, с которым они связывают и гидролизуют АТФ. Нуклеотидсвязывающий домен связывает молекулы аденозинтрифосфата (АТФ), для проведения изменений в конформации транспортёра АВС. Зрелый белок ABCA4 образует гетеродимер: два димеризованных отсека канала отличаются друг от друга. Когда трансмембранные домены расположены в мембране, они образуют бочкообразную структуру, проницаемую для ретиноидных лигандов и контролирует доступность связывающего их сайта[6]. После того, как АТФ гидролизуется в нуклеотидсвязывающем канале, они объединяются, чтобы изменить трансмембранный домен, что в свою очередь, приводит к модуляции связывания лиганда с каналом[7]. В недавно предложенной модели ретиноидной передачи, наступающей в результате переменного воздействия внешних и внутренних трансмембранных лигандосвязанных сайтов, всё управляется путём связывания АТФ. Эта модель основана на недавних структурных анализах бактериальных транспортеров ABC.
Функция
ABCR локализуется в наружном сегменте дисковых ободков палочек и колбочек. ABCR выражен гораздо меньше, чем родопсин, примерно в 1:120. Сравнение между ABCA4 млекопитающих и другими ABCs, клеточной локализации ABCA4 и анализ ABCA4 нокаутных мышей показывают, что ABCA4 может функционировать как направленная внутрь флиппаза ретиноидов.[8] Флиппаза представляет собой трансмембранный белок, который «переворачивает» свою конформацию для транспортировки материалов через мембрану. В случае ABCA4, флиппазы облегчают передачу N-ретинил-фосфатидилэтаноламина (PE-NR), ковалентного аддукта ретинальдегида[англ.] (ATR) с фосфатидилэтаноламином (PE) из ловушки внутри диска, как заряженных частиц в наружный слой цитоплазматической поверхности.[9] После транспортировки, ATR уменьшается до витамина А, а затем переносятся в пигментный эпителий сетчатки, для переработки в 11-cis-ретинал. Эта альтернативная модель доступа для ABCA4 имеет четыре этапа: (1) связывание АТФ с NBD для доставки двух NBDs вместе и выставления во внешнем вестибюле сайта с высокородственными связями, находящимся в TMD (2) связывание NR-PE/ATR на внеклеточной стороне канала (3) гидролиз АТФ для содействия открытия шлюза и движения NR-PE/ATR через мембрану к сайту низкородственных связей на внутриклеточной части TMD, (4) выделение аденозиндифосфата (АДФ) и неорганического фосфата (Рi)для освобождения связанного лиганда. Канал снова готов к передаче другой молекулы NR-PE / ATR .
ABCR — / - нокаутных мышей вызывает задержку адаптации к темноте, но в конце концов этот процесс управляется.[8] Это свидетельствует о массовых путях трансмембранной диффузии, которые удаляют ATR/NR-PE из внеклеточных мембран. После освещения сетчатки сильным светом, ATR/NR-PE значительно накапливаются в наружных сегментах. Это накопление приводит к образованию токсичной катионной бис-пиридинийной соли, N-ретинилиден-N-ретинилэтаноламина (A2E), что приводит у человека к сухой и влажной возрастной макулярной дегенерации.[10] Из этого эксперимента был сделан вывод, что ABCR играет важную роль в очистке накопленных ATR/NR-PE, чтобы предотвратить образование А2Е на внеклеточных поверхностях фоторецепторов во время восстановления.
Клиническое значение
Мутации в гене ABCA4, как известно, вызывают аутосомно-рецессивную болезнь Штаргардта, которая является наследственной ювенильной дегенерацией жёлтого пятна, причиной прогрессирующей потери фоторецепторов. Болезнь Штаргардта характеризуется снижением остроты зрения и цветового зрения, потерей центрального (макулярного) зрения, замедленной адаптацией к темноте и накоплением аутофлоресцентного липофусцина RPE[10]. Удаление NR-PE/ATR по видимому имеет важное значение для нормального восстановления и смягчения постоянной опсин-сигнализации, которая вызывает вырождение фоторецепторов. ABCA4 также снижает долгосрочные последствия накопления ATR, что приводит к необратимой привязки ATR ко второй молекуле ATR и NR-PE чтобы сформировать Дигидро-N-ретинилиден-N-ретинилфосфатидильный этаноламин (A2PE-H2). A2PE-H2 ловит ATR и накапливает в наружных сегментах для дальнейшего окисления в N-ретинилиден-N-ретинилфосфатидильный этаноламин (A2PE). После суточного дискового обновления и фагоцитоза внешнего сегмента RPE клеток, A2PE гидролизуется внутри RPE фаголизосомы, чтобы сформировать A2E.[10] Накопление А2Е, оказывает токсическое действие на первичном уровне ПЭС и разрушает вторичные фоторецепторы при макулярной дегенерации.
Дополнительные заболевания, которые можно связать с мутациями в ABCA4 включают болезнь Штаргардта, дистрофию колбочек, пигментный ретинит и возрастную макулярную дегенерацию .
Исследование GENEVA Cleft Consortium впервые выявило связь ABCA4 с заячьей губой и/или волчьей пастью и с множеством маркеров, свидетельствующих о связи и ассоциации на уровне генома[11]. Хотя SNP в этом гене связан с заячьей губой/волчьей пастью, это не даёт никаких функциональных или выраженных данных в поддержку его как этиологического гена, который может находиться в области, примыкающей к ABCA4.[12] Комбинация генома широкого объединения, вариантов редкой последовательности, кодирующей черепно-лицевую специфическую экспрессию и взаимодействие с IRF6 подтверждают роль прилегающего гена ARHGAP29, который, скорее всего играет роль этиологического гена в несиндромальной заячьей губе и/или волчьей пасти.[13]
Примечания
- ↑ 1 2 Entrez Gene: ABCA4 ATP-binding cassette, sub-family A (ABC1), member 4.
- ↑ Allikmets R., Singh N., Sun H., Shroyer N.F., Hutchinson A., Chidambaram A., Gerrard B., Baird L., Stauffer D., Peiffer A., Rattner A., Smallwood P., Li Y., Anderson K.L., Lewis R.A., Nathans J., Leppert M., Dean M., Lupski J.R. A photoreceptor cell-specific ATP-binding transporter gene (ABCR) is mutated in recessive Stargardt macular dystrophy (англ.) // Nature Genetics : journal. — 1997. — March (vol. 15, no. 3). — P. 236—246. — doi:10.1038/ng0397-236. — PMID 9054934.
- ↑ Nasonkin I., Illing M., Koehler M.R., Schmid M., Molday R.S., Weber B.H. Mapping of the rod photoreceptor ABC transporter (ABCR) to 1p21-p22.1 and identification of novel mutations in Stargardt's disease (англ.) // Human Genetics : journal. — 1998. — January (vol. 102, no. 1). — P. 21—6. — doi:10.1007/s004390050649. — PMID 9490294.
- ↑ Allikmets R., Shroyer N.F., Singh N., Seddon J.M., Lewis R.A., Bernstein P.S., Peiffer A., Zabriskie N.A., Li Y., Hutchinson A., Dean M., Lupski J.R., Leppert M. Mutation of the Stargardt disease gene (ABCR) in age-related macular degeneration (англ.) // Science : journal. — 1997. — September (vol. 277, no. 5333). — P. 1805—1807. — doi:10.1126/science.277.5333.1805. — PMID 9295268.
- ↑ Sun H., Nathans J. ABCR: rod photoreceptor-specific ABC transporter responsible for Stargardt disease (англ.) // Methods in Enzymology : journal. — 2000. — Vol. Methodds in Enzymology. — P. 879—897. — ISBN 978-0-12-182216-3. — doi:10.1016/S0076-6879(00)15888-4. — PMID 10736747.
- ↑ van Meer G., Halter D., Sprong H., Somerharju P., Egmond M.R. ABC lipid transporters: extruders, flippases, or flopless activators? (англ.) // FEBS Letters[англ.] : journal. — 2006. — February (vol. 580, no. 4). — P. 1171—1177. — doi:10.1016/j.febslet.2005.12.019. — PMID 16376334.
- ↑ Sullivan J.M. Focus on Molecules: ABCA4 (ABCR) - An import-directed photoreceptor retinoid flipase (англ.) // Experimental Eye Research : journal. — 2009. — March (vol. 89, no. 5). — P. 602—603. — doi:10.1016/j.exer.2009.03.005. — PMID 19306869. — PMC 3371273.
- ↑ 1 2 Weng J., Mata N.L., Azarian S.M., Tzekov R.T., Birch D.G., Travis G.H. Insights into the function of Rim protein in photoreceptors and etiology of Stargardt's disease from the phenotype in abcr knockout mice (англ.) // Cell : journal. — Cell Press, 1999. — July (vol. 98, no. 1). — P. 13—23. — doi:10.1016/S0092-8674(00)80602-9. — PMID 10412977.
- ↑ Molday R.S., Beharry S., Ahn J., Zhong M. Binding of N-retinylidene-PE to ABCA4 and a model for its transport across membranes (англ.) // Advances in Experimental Medicine and Biology[англ.] : journal. — Springer Nature, 2006. — Vol. Advances in Experimental Medicine and Biology. — P. 465—470. — ISBN 978-0-387-28464-4. — doi:10.1007/0-387-32442-9_64. — PMID 17249610.
- ↑ 1 2 3 Maeda A., Maeda T., Golczak M., Palczewski K. Retinopathy in mice induced by disrupted all-trans-retinal clearance (англ.) // Journal of Biological Chemistry : journal. — 2008. — September (vol. 283, no. 39). — P. 26684—26693. — doi:10.1074/jbc.M804505200. — PMID 18658157. — PMC 2546559.
- ↑ Dixon M.J., Marazita M.L., Beaty T.H., Murray J.C. Cleft lip and palate: understanding genetic and environmental influences (англ.) // Nat. Rev. Genet. : journal. — 2011. — March (vol. 12, no. 3). — P. 167—178. — doi:10.1038/nrg2933. — PMID 21331089. — PMC 3086810.
- ↑ Beaty T.H., Ruczinski I., Murray J.C., Marazita M.L., Munger R.G., Hetmanski J.B., Murray T., Redett R.J., Fallin M.D., Liang K.Y., Wu T., Patel P.J., Jin S.C., Zhang T.X., Schwender H., Wu-Chou Y.H., Chen P.K., Chong S.S., Cheah F., Yeow V., Ye X., Wang H., Huang S., Jabs E.W., Shi B., Wilcox A.J., Lie R.T., Jee S.H., Christensen K., Doheny K.F., Pugh E.W., Ling H., Scott A.F. Evidence for gene-environment interaction in a genome wide study of nonsyndromic cleft palate (англ.) // Genet. Epidemiol.[англ.] : journal. — 2011. — September (vol. 35, no. 6). — P. 469—478. — doi:10.1002/gepi.20595. — PMID 21618603. — PMC 3180858.
- ↑ Leslie E.J., Mansilla M.A., Biggs L.C., Schuette K., Bullard S., Cooper M., Dunnwald M., Lidral A.C., Marazita M.L., Beaty T.H., Murray J.C. Expression and mutation analyses implicate ARHGAP29 as the etiologic gene for the cleft lip with or without cleft palate locus identified by genome wide association on chromosome 1p22 (англ.) : journal. — 2012. — P. 1—24.
Литература
- MacDonald I.M. Genetic aspects of age-related macular degeneration (англ.) // Can. J. Ophthalmol. : journal. — 2006. — Vol. 40, no. 3. — P. 288—292. — doi:10.1139/i05-002. — PMID 15947798.
- Bonaldo M.F., Lennon G., Soares M.B. Normalization and subtraction: two approaches to facilitate gene discovery (англ.) // Genome Res. : journal. — 1997. — Vol. 6, no. 9. — P. 791—806. — doi:10.1101/gr.6.9.791. — PMID 8889548.
- Allikmets R., Singh N., Sun H., et al. A photoreceptor cell-specific ATP-binding transporter gene (ABCR) is mutated in recessive Stargardt macular dystrophy (англ.) // Nat. Genet. : journal. — 1997. — Vol. 15, no. 3. — P. 236—246. — doi:10.1038/ng0397-236. — PMID 9054934.
- Martínez-Mir A., Bayés M., Vilageliu L., et al. A new locus for autosomal recessive retinitis pigmentosa (RP19) maps to 1p13-1p21 (англ.) // Genomics. — Academic Press, 1997. — Vol. 40, no. 1. — P. 142—146. — doi:10.1006/geno.1996.4528. — PMID 9070931.
- Azarian S.M., Travis G.H. The photoreceptor rim protein is an ABC transporter encoded by the gene for recessive Stargardt's disease (ABCR) (англ.) // FEBS Lett.[англ.] : journal. — 1997. — Vol. 409, no. 2. — P. 247—252. — doi:10.1016/S0014-5793(97)00517-6. — PMID 9202155.
- Sun H., Nathans J. Stargardt's ABCR is localized to the disc membrane of retinal rod outer segments (англ.) // Nat. Genet. : journal. — 1997. — Vol. 17, no. 1. — P. 15—6. — doi:10.1038/ng0997-15. — PMID 9288089.
- Allikmets R. A photoreceptor cell-specific ATP-binding transporter gene (ABCR) is mutated in recessive Stargardt macular dystrophy (англ.) // Nat. Genet. : journal. — 1997. — Vol. 17, no. 1. — P. 122. — doi:10.1038/ng0997-122a. — PMID 9288113.
- Allikmets R., Shroyer N.F., Singh N., et al. Mutation of the Stargardt disease gene (ABCR) in age-related macular degeneration (англ.) // Science : journal. — 1997. — Vol. 277, no. 5333. — P. 1805—1807. — doi:10.1126/science.277.5333.1805. — PMID 9295268.
- Martínez-Mir A., Paloma E., Allikmets R., et al. Retinitis pigmentosa caused by a homozygous mutation in the Stargardt disease gene ABCR (англ.) // Nat. Genet. : journal. — 1998. — Vol. 18, no. 1. — P. 11—2. — doi:10.1038/ng0198-11. — PMID 9425888.
- Cremers F.P., van de Pol D.J., van Driel M., et al. Autosomal recessive retinitis pigmentosa and cone-rod dystrophy caused by splice site mutations in the Stargardt's disease gene ABCR (англ.) // Human Molecular Genetics[англ.] : journal. — Oxford University Press, 1998. — Vol. 7, no. 3. — P. 355—362. — doi:10.1093/hmg/7.3.355. — PMID 9466990.
- Nasonkin I., Illing M., Koehler M.R., et al. Mapping of the rod photoreceptor ABC transporter (ABCR) to 1p21-p22.1 and identification of novel mutations in Stargardt's disease (англ.) // Hum. Genet. : journal. — 1998. — Vol. 102, no. 1. — P. 21—6. — doi:10.1007/s004390050649. — PMID 9490294.
- Gerber S., Rozet J.M., van de Pol T.J., et al. Complete exon-intron structure of the retina-specific ATP binding transporter gene (ABCR) allows the identification of novel mutations underlying Stargardt disease (англ.) // Genomics : journal. — Academic Press, 1998. — Vol. 48, no. 1. — P. 139—142. — doi:10.1006/geno.1997.5164. — PMID 9503029.
- Azarian S.M., Megarity C.F., Weng J., et al. The human photoreceptor rim protein gene (ABCR): genomic structure and primer set information for mutation analysis (англ.) // Hum. Genet. : journal. — 1998. — Vol. 102, no. 6. — P. 699—705. — doi:10.1007/s004390050765. — PMID 9703434.
- Rozet J.M., Gerber S., Souied E., et al. Spectrum of ABCR gene mutations in autosomal recessive macular dystrophies (англ.) // Eur. J. Hum. Genet.[англ.] : journal. — 1998. — Vol. 6, no. 3. — P. 291—295. — doi:10.1038/sj.ejhg/5200221. — PMID 9781034.
- Lewis R.A., Shroyer N.F., Singh N., et al. Genotype/Phenotype analysis of a photoreceptor-specific ATP-binding cassette transporter gene, ABCR, in Stargardt disease (англ.) // Am. J. Hum. Genet.[англ.] : journal. — 1999. — Vol. 64, no. 2. — P. 422—434. — doi:10.1086/302251. — PMID 9973280. — PMC 1377752.
- Sun H., Molday R.S., Nathans J. Retinal stimulates ATP hydrolysis by purified and reconstituted ABCR, the photoreceptor-specific ATP-binding cassette transporter responsible for Stargardt disease (англ.) // J. Biol. Chem. : journal. — 1999. — Vol. 274, no. 12. — P. 8269—8281. — doi:10.1074/jbc.274.12.8269. — PMID 10075733.
- Maugeri A., van Driel M.A., van de Pol D.J., et al. The 2588G→C mutation in the ABCR gene is a mild frequent founder mutation in the Western European population and allows the classification of ABCR mutations in patients with Stargardt disease (англ.) // Am. J. Hum. Genet.[англ.] : journal. — 2000. — Vol. 64, no. 4. — P. 1024—1035. — doi:10.1086/302323. — PMID 10090887. — PMC 1377826.
- Fishman G.A., Stone E.M., Grover S., et al. Variation of clinical expression in patients with Stargardt dystrophy and sequence variations in the ABCR gene (англ.) // Arch. Ophthalmol.[англ.] : journal. — 1999. — Vol. 117, no. 4. — P. 504—510. — doi:10.1001/archopht.117.4.504. — PMID 10206579.
- Körschen H.G., Beyermann M., Müller F., et al. Interaction of glutamic-acid-rich proteins with the cGMP signalling pathway in rod photoreceptors (англ.) // Nature : journal. — 1999. — Vol. 400, no. 6746. — P. 761—766. — doi:10.1038/23468. — PMID 10466724.
- Zhang K., Garibaldi D.C., Kniazeva M., et al. A novel mutation in the ABCR gene in four patients with autosomal recessive Stargardt disease (англ.) // Am. J. Ophthalmol.[англ.] : journal. — 1999. — Vol. 128, no. 6. — P. 720—724. — doi:10.1016/S0002-9394(99)00236-6. — PMID 10612508.