DAPI
| DAPI | |
|---|---|
   | |
| Общие | |
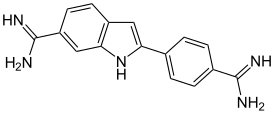
| Систематическое наименование | 2-(4-Амидинофенил)-1"Н"-индол-6-карбоксамидин |
| Хим. формула | C16H15N5 |
| Классификация | |
| Рег. номер CAS | 47165-04-8 |
| PubChem | 2954 |
| SMILES | |
| InChI | |
| ChEBI | 51231 |
| ChemSpider | 2848 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
DAPI (произносится как «DAPPY», [ˈdæpiː]), или 4',6-диамидино-2-фенилиндол, представляет собой флуоресцентный краситель, который прочно связывается с богатыми аденином и тимином областями ДНК. Он широко используется в флуоресцентной микроскопии. Поскольку DAPI может проходить через интактную клеточную мембрану, его можно использовать для окрашивания как живых, так и фиксированных клеток, хотя он менее эффективно проходит через мембрану в живых клетках и, следовательно, служит маркером жизнеспособности мембраны.
История
DAPI был впервые синтезирован в 1971 году в лаборатории Отто Данна в рамках поиска лекарств для лечения трипаносомоза. Хотя в качестве лекарства он не увенчался успехом, дальнейшие исследования показали, что он прочно связывается с ДНК и при связывании становится более флуоресцентным. Это привело к его использованию для идентификации митохондриальной ДНК при ультрацентрифугировании в 1975 году, что стало первым зарегистрированным использованием DAPI в качестве флуоресцентного красителя ДНК[1].
Сильная флуоресценция при связывании с ДНК привела к быстрому внедрению DAPI для флуоресцентного окрашивания ДНК для флуоресцентной микроскопии. Его использование для обнаружения ДНК в клетках растений, метазоа и бактерий и вирусных частицах было продемонстрировано в конце 1970-х годов, а количественное окрашивание ДНК внутри клеток было продемонстрировано в 1977 году. Примерно в это же время было продемонстрировано использование DAPI в качестве красителя ДНК для проточной цитометрии[1].
Флуоресцентные свойства
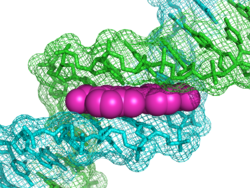
При связывании с двухцепочечной ДНК DAPI имеет максимум поглощения при длине волны 358 нм (ультрафиолет), а его максимум излучения находится на уровне 461 нм (синий). Поэтому для флуоресцентной микроскопии DAPI возбуждают ультрафиолетовым светом и обнаруживают через сине-голубой фильтр. Пик излучения достаточно широкий[2]. DAPI также связывается с РНК, хотя и не так сильно флуоресцирует. Его эмиссия приближается к 500 нм при связывании с РНК[3][4].
Голубое излучение DAPI удобно для микроскопистов, которые хотят использовать несколько флуоресцентных красителей в одном образце. Существует некоторое перекрытие флуоресценции между DAPI и зелеными флуоресцентными молекулами, такими как флуоресцеин и зеленый флуоресцентный белок (GFP), но эффект от этого невелик. Использование спектрального разделения может объяснить этот эффект, если требуется чрезвычайно точный анализ изображения.
Помимо аналитической флуоресцентной световой микроскопии DAPI также популярен для мечения клеточных культур для обнаружения ДНК загрязняющих микоплазм или вирусов . Меченые частицы микоплазмы или вируса в питательной среде флуоресцируют после окрашивания DAPI, что облегчает их обнаружение[5].
Моделирование абсорбционных и флуоресцентных свойств
Этот флуоресцентный зонд ДНК был эффективно смоделирован[6] с использованием зависящей от времени теории функционала плотности в сочетании с версией IEF модели поляризуемого континуума. Это квантово-механическое моделирование рационализировало поведение поглощения и флуоресценции, обусловленное связыванием малой бороздки и интеркаляцией в кармане ДНК, с точки зрения снижения структурной гибкости и поляризации.
Живые клетки и токсичность

DAPI можно использовать для окрашивания фиксированных клеток. Концентрация DAPI, необходимая для окрашивания живых клеток, обычно очень высока; он редко используется для живых клеток[7]. Он помечен как нетоксичный в своем паспорте безопасности[8], и хотя не было показано, что он обладает мутагенным действием по отношению к E. coli[9], он помечен как известный мутаген в информации производителя[10]. Поскольку это небольшое ДНК-связывающее соединение, оно может оказывать некоторые канцерогенные эффекты, и следует соблюдать осторожность при обращении с ним и его утилизации.
Альтернативы
Краски Хехста похожи на DAPI в том, что они также представляют собой синие флуоресцентные пятна ДНК, совместимые как с живыми, так и с фиксированными клетками, а также видимые с использованием тех же настроек фильтра оборудования, что и для DAPI.
См. также
- ДНК-связывающий лиганд[англ.]
- Краска Хехста[англ.]
- Лекситропсин[англ.]
- Нетропсин[англ.]
- Пентамидин[англ.]
Примечания
- ↑ 1 2 Jan Kapuscinski. DAPI: a DNA-Specific Fluorescent Probe (англ.) // Biotechnic & Histochemistry. — 1995-01. — Vol. 70, iss. 5. — P. 220–233. — ISSN 1473-7760 1052-0295, 1473-7760. — doi:10.3109/10520299509108199.
- ↑ Invitrogen, DAPI Nucleic Acid Stain Архивировано 8 декабря 2009 года.
- ↑ Scott Prahl, DAPI Архивная копия от 29 октября 2013 на Wayback Machine. 2009-12-08.
- ↑ J Kapuscinski. Interactions of nucleic acids with fluorescent dyes: spectral properties of condensed complexes. (англ.) // Journal of Histochemistry & Cytochemistry. — 1990-09. — Vol. 38, iss. 9. — P. 1323–1329. — ISSN 1551-5044 0022-1554, 1551-5044. — doi:10.1177/38.9.1696951. Архивировано 22 сентября 2022 года.
- ↑ W. C. Russell, Carol Newman, D. H. Williamson. A simple cytochemical technique for demonstration of DNA in cells infected with mycoplasmas and viruses (англ.) // Nature. — 1975-02-06. — Vol. 253, iss. 5491. — P. 461–462. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/253461a0. Архивировано 20 сентября 2022 года.
- ↑ Alessandro Biancardi, Tarita Biver, Fernando Secco, Benedetta Mennucci. An investigation of the photophysical properties of minor groove bound and intercalated DAPI through quantum-mechanical and spectroscopic tools (англ.) // Physical Chemistry Chemical Physics. — 2013. — Vol. 15, iss. 13. — P. 4596. — ISSN 1463-9084 1463-9076, 1463-9084. — doi:10.1039/c3cp44058c.
- ↑ Daniele Zink, Nicolas Sadoni, Ernst Stelzer. Visualizing chromatin and chromosomes in living cells (англ.) // Methods. — 2003-01. — Vol. 29, iss. 1. — P. 42–50. — doi:10.1016/S1046-2023(02)00289-X. Архивировано 15 июня 2022 года.
- ↑ DAPI MATERIAL SAFETY DATA SHEET. kpl.com
- ↑ Toshihiro Ohta, Shin-ichi Tokishita, Hideo Yamagata. Ethidium bromide and SYBR Green I enhance the genotoxicity of UV-irradiation and chemical mutagens in E. coli (англ.) // Mutation Research/Genetic Toxicology and Environmental Mutagenesis. — 2001-05. — Vol. 492, iss. 1—2. — P. 91–97. — doi:10.1016/S1383-5718(01)00155-3. Архивировано 16 октября 2022 года.
- ↑ Invitrogen, DAPI Nucleic Acid Stain Архивировано 8 декабря 2009 года.













