Апопто́з — регулируемый процесс программируемой клеточной гибели, в результате которого клетка распадается на отдельные апоптотические тельца, ограниченные плазматической мембраной. Фрагменты погибшей клетки обычно очень быстро фагоцитируются макрофагами либо соседними клетками, минуя развитие воспалительной реакции. Морфологически регистрируемый процесс апоптоза продолжается 1—3 часа. Одной из основных функций апоптоза является уничтожение дефектных клеток. В многоклеточных организмах апоптоз к тому же задействован в процессах дифференциации и морфогенеза, в поддержании клеточного гомеостаза, в обеспечении важных аспектов развития и функционирования иммунной системы. Апоптоз наблюдается у всех эукариотов, начиная от одноклеточных простейших и вплоть до высших организмов. В программируемой смерти прокариотов участвуют функциональные аналоги эукариотических белков апоптоза.

Мито́з, или кариокине́з — непрямое деление клетки, наиболее распространённый способ размножения эукариотических клеток. Биологическое значение митоза состоит в строго одинаковом распределении хромосом между дочерними ядрами, что обеспечивает образование генетически одинаковых дочерних клеток и сохраняет преемственность в ряду клеточных поколений. Перед делением число хромосом в клетке увеличивается в два раза продольным разделением на две части каждой из них, поэтому в каждую из дочерних клеток переходит столько же хромосом, сколько их было в родительской клетке.
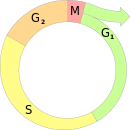
Кле́точный цикл — период существования клетки от момента её образования путём деления материнской клетки до собственного деления или гибели.

Интерфа́за (англ. interphase) — период клеточного цикла, подразделяющийся на G1-,G₀-, S- и G2-фазы. Во время интерфазы клетка готовится к будущему делению: растёт, удваивает количество цитоплазмы, клеточных белков и органелл. В S-фазе происходит удвоение ДНК и центросом (клеточных центров).
Дифференцировка клеток — процесс реализации генетически обусловленной программы формирования специализированного фенотипа клеток, отражающего их способность к тем или иным профильным функциям. Дифференцировка меняет функцию клетки, её размер, форму и метаболическую активность.

Старение — рост риска смерти от естественных причин с течением времени, биологический процесс постепенного нарушения и потери важных функций организма или его частей, в частности, способности к размножению и регенерации. Вследствие старения организм становится менее приспособленным к условиям окружающей среды, уменьшает и теряет свою способность бороться с хищниками и противостоять болезням и травмам. Наука, которая изучает старение человека, называется геронтологией, а её раздел, который изучает непосредственно биологическую сторону старения, носит название биогеронтология.

Старение человека, как и старение других организмов, — это биологический процесс постепенной деградации частей и систем организма человека и последствия этого процесса. Физиология процесса старения аналогична физиологии старения других млекопитающих, однако некоторые аспекты этого процесса, например, потеря умственных способностей, имеют большее значение для человека. Для общества в целом существенное значение имеют социальные и экономические факторы.
Ген-супрессор опухолей — ген, продукт которого обеспечивает профилактику опухолевой трансформации клеток. Белковые продукты генов-супрессоров называют белками-супрессорами или антионкобелками. Кроме того, антионкогены могут кодировать и микроРНК. Гены-супрессоры обычно обнаруживаются при инактивирующих мутациях, которые фенотипически проявляются в формировании опухолей. Функционально гены-супрессоры противоположны онкогенам и часто негативно регулируют деление и рост клеток, а также уход от апоптоза. Наиболее известными белками-супрессорами являются p53, pRb и PTEN.

Ко́мплекс, стимули́рующий анафа́зу, также называемый циклосома, представляет собой крупное белковое соединение, которому отводится решающая роль в активации анафазы митоза. Функционально комплекс стимуляции анафазы представляет собой убиквитинлигазу и катализирует реакции присоединения молекул убиквитина к различным целевым белкам, которые в итоге подвергаются протеолизу.

Ко́мплекс SCF — белковое соединение, играющее существенную роль в регуляции клеточного цикла. В структуре комплекса, прежде всего, выделяют ядро, состоящее из трёх субъединиц: структурообразующего белка куллина, каталитического RING-домена и адаптерного белка. Через RING-домен с ядром комплекса SCF соединяется убиквитин-конъюгирующий фермент, который обеспечивает перенос молекулы убиквитина на белок-мишень. Через адаптерный домен с комплексом SCF соединяется субстрат-специфичный домен, обеспечивающий связывание целевого белка.

Ингиби́тор цикли́н-зави́симой кина́зы (англ. Cdk inhibitor protein, CKI, CDI, CDKI) — белок, блокирующий активность циклин-зависимой киназы отдельно или циклин-зависимой киназы в комплексе с циклином. Обычно сдерживающая активность CKI приурочена к фазе G1 клеточного цикла. К тому же, активация CKI может происходить в ответ на повреждения ДНК или может быть вызвана внеклеточными ингибирующими сигналами.

S-фа́за — фаза клеточного цикла, в которой происходит репликация ДНК. Стадия интерфазы, расположенная между G1- и G2-фазами. Длительность в большинстве клеток составляет 8—12 часов. В ходе дробления бластомеры многих организмов делятся раз в 20—30 минут, причём сильно сокращаются G1 и G2-периоды: S-фаза почти равна по длительности интерфазе.

G1-фа́за (от англ. Gap 1 phase) — первая из четырёх фаз клеточного цикла эукариотических клеток. На этом этапе интерфазы клетка увеличивается в размерах и синтезирует мРНК и белки, готовясь к последующему после интерфазы митозу. G1-фаза завершается с началом S-фазы интерфазы.

Клеточное старение, или сенесценция — это вызванная стрессом необратимая остановка клеточного цикла соматических клеток, способных к пролиферации. В качестве стресса могут выступать воздействия, вызывающие трудно репарируемые повреждения ДНК, например, ионизирующая радиация. Также клеточное старение может запускаться из-за слишком коротких теломер, когда теломеры воспринимаются клеткой как повреждение ДНК, а именно, как двунитевой разрыв ДНК. Укорочение теломер происходит в результате множественных циклов репликации хромосомной ДНК в процессе неоднократных клеточных делений. Процесс клеточного старения, связанный с укорочением теломер, также называется репликативным старением клетки, и с ним связан предел на число делений соматической клетки, называемый пределом Хейфлика. Клеточное старение может быть вызвано также избыточной митогенной стимуляцией, происходящей, например, в результате активации онкогенов.
Мантийноклеточная лимфома является уникальным подвидом неходжкинской лимфомы. Для неё весьма характерна хромосомная транслокация t(11;14)(q13;q32) и гиперэкспрессия ядерного белка циклин D1.
Клональное старение — вид клеточного старения, свойство ряда митотически делящихся клеток, например соматических клеток или некоторых простейших, проявляющееся в замедлении и конечной остановке клеточных делений. Преодолеть клональное старение позволяют: для простейших — половое размножение, после которого организм восстанавливает скорость делений, а для соматических клеток — раковая трансформация или внешние воздействия. Показано также наличие клеточного старения и для бактерий, например E.coli, C.crescentus.
То́чка рестри́кции (англ. restriction point, R point) — точка в G1-фазе клеточного цикла животных, в которой клетка принимает окончательное решение двигаться дальше по клеточному циклу. Точка рестрикции делит G1-фазу на два периода. В ходе первого из них (до R) для продвижения клетки по циклу ей необходима постоянная стимуляция митогенными сигналами (в том числе факторами роста), а также интенсивный синтез белка. После прохождения R подобная стимуляция уже не требуется.
Митогены — пептиды или небольшие белки, индуцирующие клеточное деление митоз. Митогенезом называют вступление клетки в процесс деления, как правило, под действием митогена. Механизм действия митогенов обеспечивается путями передачи сигнала, включающими митоген-активируемые протеинкиназы (MAPK) и приводящими к митозу.

Контрольные точки клеточного цикла — это механизмы контроля в эукариотическом клеточном цикле, которые обеспечивают его правильное развитие. Каждая контрольная точка служит потенциальной точкой завершения клеточного цикла, во время которой оцениваются условия клетки, при этом продвижение через различные фазы клеточного цикла происходит только при соблюдении благоприятных условий. В клеточном цикле есть много контрольных точек, но три основных из них: контрольная точка G1, также известная как контрольная точка начала или ограничения или основная контрольная точка; контрольная точка G2/M; и переход от метафазы к анафазе, также известный как контрольная точка веретена. Прохождение через эти контрольные точки в значительной степени определяется активацией циклин-зависимых киназ регуляторными белковыми субъединицами, называемыми циклинами, различные формы которых продуцируются на каждой стадии клеточного цикла для контроля специфических событий, происходящих в нём.
Ряд биохимических переключателей контролируют переходы между различными фазами клеточного цикла и внутри них. Клеточный цикл представляет собой серию сложных, упорядоченных, последовательных событий, которые контролируют деление одной клетки на две клетки и включают в себя несколько различных фаз. Фазы включают фазы G1 и G2, репликацию ДНК или S-фазу, а также фактический процесс клеточного деления, митоза или М-фазу. Во время М-фазы хромосомы расходятся и происходит цитокинез.