HslVU
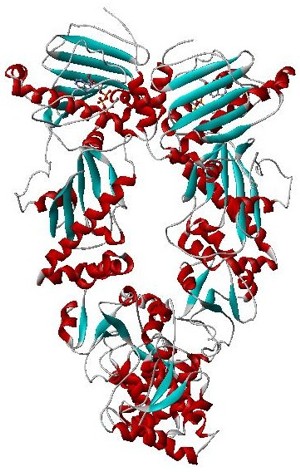
HslVU (HslUV, ClpYQ) — протеаза из группы АТФ-зависимых протеаз, присутствующая у многих бактерий, включая Escherichii coli и Bacillus subtilis. Состоит из двух компонентов, HslU (ClpY) — АТФ-зависимый шаперон и активатор протеолитической активности у HslV (ClpQ) — собственно протеазы. Активный комплекс состоит из двух колец из шести белковых субъединиц HslV, соединённых вместе, и по кольцу из шести белковых субъединиц HslU с каждой стороны. Кольца соединены вместе, образуя полый цилиндр, при этом кольца HslU находятся со внешней стороны. Как и у всех других АТФ-зависимых протеаз, активный сайт находится внутри цилиндра, и полипептидный субстрат должен быть развёрнут и активно перемещён внутрь для того, чтобы произошел протеолиз[1],[2],[3],[4].
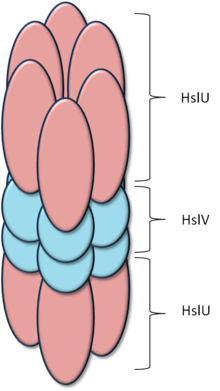
HslU
HslU является шапероном, распознающим, разворачивающим и преносящим белки-субстраты внутрь полости протеазной части. HslU, является членом обширного семейства ААА АТФаз (ATPases Associated with diverse cellular Activities, АТФазы связанные с различными клеточными активностями)[5],[6]. HslU — гомолог СlpX, АТФ-зависимого шаперона, компонента ClpXP протеазы[7]. Благодаря этому, а также определённой схожести строения и функционирования, HslVU получил своё второе имя, также широко используемое — «ClpYQ». HslU состоит из трёх доменов: N-концевой домен, вставленный в него Промежуточный домен (англ. «Intermediate», I-домен) и С-концевой домен. В N-концевом домене находятся традиционные мотивы Walker A и Walker B, участвующие в связывании и расщеплении АТФ[7]. Промежуточный домен ответственен за связывание и распознавание субстратов[8]. С-концевой домен вместе с частью N-концевого домена участвует во взаимодействии с HslV[4]. N-концевой домен содержит GYVG-мотив, необходимый для разворачивания субстрата и перенесения его в HslV[7].


HslV
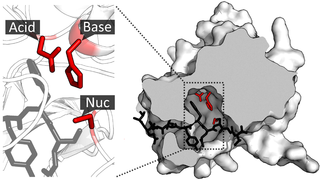
В отличие от HslU, имеющего гомологию с ClpX, HslV не имеет гомологии с ClpP или какой-нибудь другой бактериальной протеазой. Вместо этого он имеет слабую гомологию с протеолитической субъединицей эукариотической протеосомы[9]. Так же как и у протеосомы каталитическую роль выполняет N-концевой остаток треонина[10] (хотя у B. subtilis N-концевой и каталитический остаток — серин)[11]. Таким образом HslV принадлежит к группе N-концевых протеаз[12]. HslV является α+β белком. Сам по себе HslV слабо активен. Необходимо взаимодействие с HslU, чтобы активировать протеазный компонент[4].
Распространение
HslVU не представлен так широко в различных группах бактерий, как другие АТФ-зависимые протеазы, такие как ClpP, Lon, FtsH. Тем не менее HslVU присутствует у α-, γ- и ε-протеобактерий, фирмикут, спирохет и таких древних групп как Aquifex и Thermotoga[12]. Кроме того, он присутствует в митохондриях таких групп низших эукариот как Trypanosoma, Leishmania, Plasmodium, Amoebozoa, Chromalveolata, Rhizaria, Excavata, а также некоторых растений[13].
У E. coli субстратная специфичность HslVU во многом пересекается со специфичностью Lon[14]. Также как и Lon, HslVU распознаёт и разрушает неправильно свёрнутые или аггрегированные белки, особенно при тепловом шоке[15]. Два классических субстрата Lon — ингибитор клеточного деления SulA и регулятора синтеза бактериальной капсулы RcsA, являются также субстратами для HslVU[16],[17]. HslVU также способен разрушать белки с SsrA-хвостом[18]. Ещё одним субстратом для HslVU является σ32 — сигма фактор, отвечающий за транскрипцию белков теплового шока[15].
Регуляция
HslU и HslV находятся друг за другом в одном опероне. Экспрессия этого оперона индуцируется при тепловом шоке, что повышает в несколько раз уровень этой протеазы в клетке[19]. При этом HslVU участвует в разрушении аггрегированных и денатурированных теплом белков. Как большинство других белков теплового шока, оперон индуцируется σ32 — сигма фактором теплового шока[20].
Примечания
- ↑ Six-fold rotational symmetry of ClpQ, the E. coli homolog of the 20S proteasome, and its ATP-dependent activator, ClpY. Kessel et al. FEBS Lett. 1996 Dec 2;398(2-3):274-8. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ HslV-HslU: A novel ATP-dependent protease complex in Escherichia coli related to the eukaryotic proteasome. Rohrwild et al. Proc Natl Acad Sci U S A. 1996 Jun 11;93(12):5808-13. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ Crystal structures of the HslVU peptidase-ATPase complex reveal an ATP-dependent proteolysis mechanism. Wang et al. Structure. 2001 Feb 7;9(2):177-84. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ 1 2 3 Functional interactions of HslV (ClpQ) with the ATPase HslU (ClpY). Ramachandran et al. Proc Natl Acad Sci U S A. 2002 May 28;99(11):7396-401. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ Distantly related sequences in the alpha- and beta-subunits of ATP synthase, myosin, kinases and other ATP-requiring enzymes and a common nucleotide binding fold. Walker et al. EMBO J. 1982;1(8):945-51. Дата обращения: 3 октября 2017. Архивировано 25 октября 2016 года.
- ↑ The heat-shock protein HslVU from Escherichia coli is a protein-activated ATPase as well as an ATP-dependent proteinase. Seol et al. Eur J Biochem. 1997 Aug 1;247(3):1143-50. Дата обращения: 3 октября 2017. Архивировано 25 октября 2016 года.
- ↑ 1 2 3 Sequence analysis of four new heat-shock genes constituting the hslTS/ibpAB and hslVU operons in Escherichia coli. Chuang et al. Gene. 1993 Nov 30;134(1):1-6. Дата обращения: 3 октября 2017. Архивировано 25 октября 2016 года.
- ↑ Characterization of the Escherichia coli ClpY (HslU) substrate recognition site in the ClpYQ (HslUV) protease using the yeast two-hybrid system. Lien et al. J Bacteriol. 2009 Jul;191(13):4218-31. doi: 10.1128/JB.00089-09. Epub 2009 Apr 24. Дата обращения: 3 октября 2017. Архивировано 25 октября 2016 года.
- ↑ Proteasomes and other self-compartmentalizing proteases in prokaryotes. De Mot et al. Trends Microbiol. 1999 Feb;7(2):88-92. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ Identification and characterization of HsIV HsIU (ClpQ ClpY) proteins involved in overall proteolysis of misfolded proteins in Escherichia coli. Missiakas et al. EMBO J. 1996 Dec 16;15(24):6899-909. Дата обращения: 3 октября 2017. Архивировано 30 мая 2016 года.
- ↑ The ATP-dependent CodWX (HslVU) protease in Bacillus subtilis is an N-terminal serine protease. Kang et al. EMBO J. 2001 Feb 15;20(4):734-42. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ 1 2 Семейство Т1. Дата обращения: 15 декабря 2013. Архивировано 15 декабря 2013 года.
- ↑ Eubacterial HslV and HslU subunits homologs in primordial eukaryotes. Couvreur et al. J Mol Biol Evol. 2002 Dec;19(12):2110-7. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ Redundant in vivo proteolytic activities of Escherichia coli Lon and the ClpYQ (HslUV) protease. Wu et al. J Bacteriol. J Bacteriol. 1999 Jun;181(12):3681-7. Дата обращения: 3 октября 2017. Архивировано 11 апреля 2015 года.
- ↑ 1 2 Synergistic roles of HslVU and other ATP-dependent proteases in controlling in vivo turnover of sigma32 and abnormal proteins in Escherichia coli. Kanemori et al. J Bacteriol. 1997 Dec;179(23):7219-25. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ Overexpression of the hslVU operon suppresses SOS-mediated inhibition of cell division in Escherichia coli. Khattar FEBS Lett. 1997 Sep 8;414(2):402-4. Дата обращения: 3 октября 2017. Архивировано 28 мая 2016 года.
- ↑ Regulation of RcsA by the ClpYQ (HslUV) protease in Escherichia coli. Kuo et al. Microbiology. 2004 Feb;150(Pt 2):437-46. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.
- ↑ Lies and Maurizi, J Biol Chem. 2008 Aug 22;283(34):22918-29. doi: 10.1074/jbc.M801692200. Epub 2008 Jun 12. Дата обращения: 3 октября 2017. Архивировано 8 сентября 2017 года.
- ↑ Characterization of twenty-six new heat shock genes of Escherichia coli. Chuang and Blattner J Bacteriol. 1993 Aug;175(16):5242-52. Дата обращения: 3 октября 2017. Архивировано 9 апреля 2015 года.
- ↑ Regulation of clpQ⁺Y⁺ (hslV⁺U⁺) gene expression in Escherichia coli. Lien et al. Open Microbiol J. 2009;3:29-39. doi: 10.2174/1874285800903010029. Epub 2009 Mar 17. Дата обращения: 3 октября 2017. Архивировано 15 декабря 2013 года.