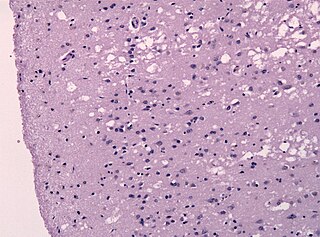
Прио́ны — особый класс инфекционных патогенов, не содержащих нуклеиновых кислот. Прионы представляют собой белки с аномальной третичной структурой. Это положение лежит в основе прионной гипотезы, однако насчёт состава прионов существуют и другие точки зрения.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
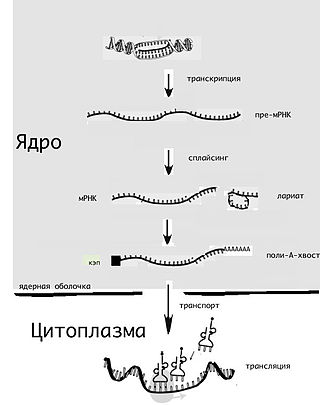
Ма́тричная рибонуклеи́новая кислота́ — РНК, содержащая информацию о первичной структуре белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.

Убиквити́н — небольшой консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации других белков, а также в модификации их функций. Он присутствует почти во всех тканях многоклеточных эукариот, а также у одноклеточных эукариотических организмов. Убиквитин был открыт в 1975 году Гидеоном Голдштейном с соавторами и охарактеризован в 70—80-х годах XX века. В геноме человека есть четыре гена, кодирующих убиквитин: UBB, UBC, UBA52 и RPS27A.
Двигательный белок, моторный белок — класс молекулярных моторов, способных перемещаться. Выделяют ротационные (АТФ-синтаза) и линейные моторные белки. Функционирование моторных белков осуществляется посредством гидролиза АТФ, что позволяет молекуле белка преобразовывать химическую энергию в механическую работу.
Рецепторы, сопряжённые с G-белком,, также известные как семиспиральные рецепторы или серпентины, составляют большое семейство трансмембранных рецепторов. GPCR выполняют функцию активаторов внутриклеточных путей передачи сигнала, приводящими в итоге к клеточному ответу. Рецепторы этого семейства обнаружены только в клетках эукариот: у дрожжей, растений, хоанофлагеллят и животных. Эндогенные лиганды-агонисты, которые связываются и активируют эти рецепторы, включают гормоны, нейромедиаторы, светочувствительные вещества, пахучие вещества, феромоны и варьируются в своих размерах от небольших молекул и пептидов до белков. Нарушение работы GPCR приводит к возникновению множества различных заболеваний, а сами рецепторы являются мишенью до 40 % выпускаемых лекарств. Точный размер надсемейства GPCR не известен, но почти 800 различных человеческих генов были предсказаны из анализа последовательности генома. Несмотря на многочисленные схемы, было предложено разделить надсемейство на три основных класса.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот, имеющих гидроксильные группы или гетероциклической аминогруппы гистидина.

Аквапорины — интегральные мембранные протеины, формирующие поры в мембранах клеток. Семейство аквапоринов входит в более крупное семейство основных внутренних белков, наиболее типичный представитель которых — основной внутренний белок волокон хрусталика (MIP).

PRNP — ген, расположенный на коротком плече 20-й хромосомы. Кодирует нормальный прионный белок (PrPC) и изоформу этого белка — прионный белок PrPSc, связанный с заболеваниями. Пока не ясно, как именно PrPC превращается в PrPSc, как реплицируется PrPSc и почему его накопление вызывает дегенерацию нейронов.
Protein Data Bank, PDB — банк данных трёхмерных структур белков и нуклеиновых кислот. Информация, полученная методами рентгеновской кристаллографии или ЯМР-спектроскопии, и, всё чаще, методом криоэлектронной микроскопии вносится в базу данных биологами и биохимиками со всего мира, и доступна бесплатно через интернет сайты организаций-членов.
Система антигенов Kell — группа антигенов на поверхности эритроцитов, являющихся важными детерминантами крови и служащих мишенью для многих аутоиммунных или аллоиммунных заболеваний, уничтожающих эритроциты. Показатель Kell обозначается как K, k и Kp. Антигены Kell представляют собой пептиды, обнаруженные в белке kell, 93 кДа трансмембранной цинко-зависимой эндопептидазе, которая отвечает за расщепление эндотелина-3.

CD2 — мембранный белок, молекула межклеточной адгезии, экспрессирована на поверхности T-лимфоцитов и клеток-киллеров (NK). Относится к белкам суперсемейства иммуноглобулинов.

Белок-белковые взаимодействия (ББВ) — обладающие высокой специфичностью физические контакты между двумя и более белками. Эти контакты образуются в результате биохимических событий с помощью электростатических взаимодействий, в том числе гидрофобного эффекта.

Гороховый протеин — концентрированная смесь белков, получаемая из зерен гороха посевного. Гороховый протеин наиболее часто используется в спортивном, диетическом или вегетарианском питании.

SMC4, или белок структурной поддержки хромосом номер четыре, также известный как хромосом-ассоцированный полипептид C или XCAP-C гомолог — это белок, который у человека кодируется геном SMC4. SMC-4 является основной субъединицей конденсина I и II, крупных белковых комплексов, участвующих в организации хромосом высокого порядка, включая конденсацию и сегрегацию. Белок SMC4 обычно ассоциирован с белком SMC2, другим белковым комплексом из семейства SMC-белков. SMC-4 димеризуется с SMC-2, создавая гибкую и динамичную структуру голокомплекса конденсинов. Показано, что сверхэкспрессия белка SMC-4 влияет на канцерогенез.
BMPR1B — белок, закодированный у человека геном BMPR1B, также называемый CDw293.
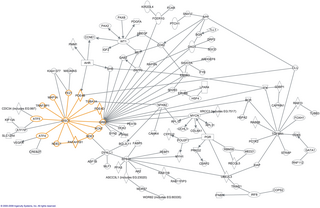
Интеракто́м — термин молекулярной биологии, обозначающий полный набор взаимодействий между молекулами в отдельной клетке. Интерактом включает как непосредственные физические контакты между белками, так и непрямые взаимодействия генов.

Бета-спираль — это тандемная структура повтора белка, образованная объединением параллельных бета-цепей в спиральном узоре с двумя или тремя гранями. Бета-спираль — это тип соленоидного белкового домена. Структура стабилизируется межцепочечными водородными связями, белок-белковыми взаимодействиями, а иногда и связанными ионами металлов. Идентифицированы как левозакрученная, так и правозакрученная бета-спирали. Двухцепочечные бета-спирали также являются очень частой особенностью белков и обычно синонимичны укладке «Желейного рулета»
Полипролиновая спираль — это тип вторичной структуры белка, который встречается в последовательностях аминокислот, содержащих повторяющиеся остатки пролина. Левозакрученная спираль полипролина II образуется, когда все последовательные аминокислотные остатки принимают двугранные углы основной цепи примерно и имеют транс- изомеры своих пептидных связей. Эта конформация PPII также характерна для белков и полипептидов с другими аминокислотами, кроме пролина. Аналогичным образом, более компактная правозакрученная спираль полипролина I образуется, когда все последовательные остатки принимают двугранные углы основной цепи примерно и имеют цис- изомеры своих пептидных связей. Из двадцати обычных встречающихся в природе аминокислот только пролин, вероятно, принимает цис- изомер пептидной связи, особенно пептидную связь X-Про; стерические и электронные факторы в значительной степени благоприятствуют транс- изомеру в большинстве других пептидных связей. Однако пептидные связи, которые заменяют пролин другой N- замещенной аминокислотой, также могут принимать цис- изомер.

Совместительство белков — это явление, при котором белок может выполнять более одной функции. Белки предков, работающие по совместительству, изначально обладали одной функцией, но в процессе эволюции приобрели дополнительные функции. Многие из этих белков являются ферментами; другие являются рецепторами, ионными каналами или шаперонами. Наиболее распространенной основной функцией подрабатывающих белков является ферментативный катализ, но эти ферменты приобрели вторичные неферментативные роли. Некоторые примеры функций подрабатывающих белков, вторичных по отношению к катализу, включают передачу сигнала, регуляцию транскрипции, апоптоз, подвижность и структурную деятельность.












