IRE (биология)

Железозави́симый элеме́нт (англ. Iron response element, IRE) — особый регуляторный элемент, содержащийся в 5′-нетранслируемой области мРНК белков, как правило, участвующих в метаболизме железа. Наиболее известным белком, мРНК которого содержит IRE, является ферритин, связывающий Fe3+. Регуляция, осуществляемая IRE, зависит от концентрации железа в клетке. IRE встречаются у самых разнообразных эукариот, но мало представлены среди растений[1].
Механизм действия

IRE имеется в 5′-UTR мРНК таких белков, как ферритин, трансферриновый рецептор[англ.], эритроид-специфичная синтаза аминолевулиновой кислоты (эритроцитарная форма eALAS или ALAS2), митохондриальная аконитаза, ферропортин[англ.], переносчик двухвалентных металлов[англ.] (англ. divalent metal transporter 1 (DMT1))[2]. Обычно белки, чьи мРНК содержат IRE, участвуют в метаболизме железа, но есть и исключения. Так, IRE есть в мРНК гена уже упоминавшейся аконитазы[3]; гена CDC42BPA, кодирующего киназу, задействованную в реорганизации цитоскелета[4]; гена EPAS1, кодирующего транскрипционный фактор, участвующий в кислородозависимой регуляции некоторых генов[5]; гена CDC14A, кодирующего фосфатазу, участвующую в контроле клеточного цикла[6] и взаимодействующую с интерфазными центросомами[7].
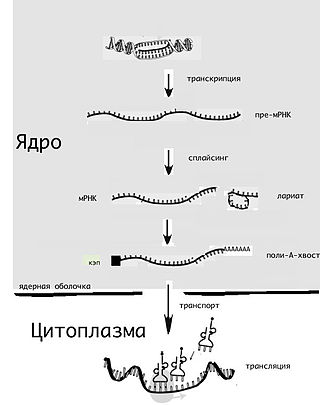
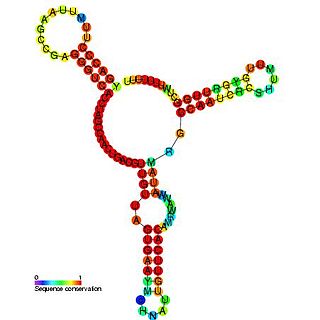
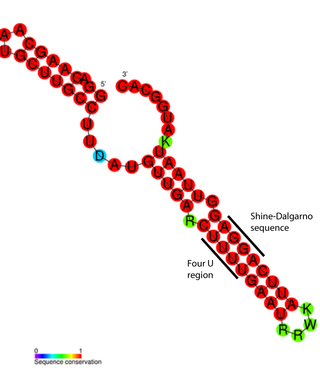
У ферритиновой мРНК IRE представляет собой последовательность длиной 28 нуклеотидов в 5′-UTR, имеющую тенденцию к образованию «дефектной» шпильки, то есть шпильки с выпетливаниями. Кроме того, последовательности, соседствующие с IRE с обеих сторон, взаимно комплементарны и формируют стеблевую структуру (англ. flanking region, FL), так что IRE оказывается частью длинной составной шпильки, которая может укладываться в третичную структуру. Эта шпилька находится вблизи кэпа (на расстоянии около 10 нуклеотидов), и в стабилизированном виде она препятствует посадке на мРНК малой рибосомной субъединицы и, таким образом, блокирует инициацию трансляции[8].
IRE ферритина способен связываться с особым белком — IRE-BP[англ.] (англ. IRE-binding protein). Этот белок оказывает репрессирующее действие на трансляцию, поскольку стабилизирует вышеописанную шпильку вблизи кэпа. Так происходит только в отсутствие Fe3+. В присутствии же Fe3+ сродство этого белка к шпильке снижается, шпилька дестабилизируется и становится доступной для рибосомы. В результате начинается трансляция, и образующийся ферритин начинает связывать избыток Fe3+[8].

Репрессорный белок IRE-BP оказался идентичен аконитазе (фермент цикла Кребса, превращающий цитрат в изоцитрат). Этот фермент содержит в своём активном центре железосерный кластер, необходимый для его работы. При недостатке Fe3+ железо-серный кластер разрушается, фермент теряет аконитазную активность и превращается в IRE-BP, который уже способен репрессировать ферритиновую мРНК. Аналогичное явление имеет место в случае мРНК эритроид-специфичной синтазы δ-аминолевулиновой кислоты (eALAS). При этом у мРНК eALAS и ферритина положение IRE относительно 5′-конца эволюционно консервативно: IRE всегда располагается в пределах первых 40 нуклеотидов мРНК, и вставка дополнительных нуклеотидом между IRE и 5′-концом приводит к ослаблению или исчезновению репрессирующего эффекта, что согласуется с описанной выше моделью работы IRE, утверждающей, что шпилька, препятствующая посадке рибосомы, должна находиться рядом с кэпом[9].
Клиническое значение
Мутации, затрагивающие IRE, могут приводить к появлению болезненных состояний, так как они разрушают нормальную регуляцию экспрессию генов. К числу таких заболеваний относится синдром наследственной гиперферритинемии/катаракты, развивающаяся при нарушениях метаболизма железа[10]. Кроме того, установлено, что трансляция белка-предшественника бета-амилоида также контролируется IRE, причём его IRE тоже способен связываться с IRE-BP, поэтому не исключено, что IRE может играть определённую роль в развитии болезни Альцгеймера[11].
Примечания
- ↑ R. Leipuviene & E. C. Theil. The family of iron responsive RNA structures regulated by changes in cellular iron and oxygen (англ.) // Cellular and Molecular Life Sciences : journal. — 2007. — November (vol. 64, no. 22). — P. 2945—2955. — doi:10.1007/s00018-007-7198-4. — PMID 17849083.
- ↑ Paul Piccinelli, Tore Samuelsson. Evolution of the iron-responsive element // RNA. — 2007. — Т. 13, № 7. — С. 952—966. — doi:10.1261/rna.464807.
- ↑ M. J. Gruer, P. J. Artymiuk & J. R. Guest. The aconitase family: three structural variations on a common theme (англ.) // Trends in Biochemical Sciences[англ.] : journal. — Cell Press, 1997. — January (vol. 22, no. 1). — P. 3—6. — doi:10.1016/S0968-0004(96)10069-4. — PMID 9020582.
- ↑ T. Leung, X. Q. Chen, I. Tan, E. Manser & L. Lim. Myotonic dystrophy kinase-related Cdc42-binding kinase acts as a Cdc42 effector in promoting cytoskeletal reorganization (англ.) // Molecular and cellular biology : journal. — 1998. — January (vol. 18, no. 1). — P. 130—140. — PMID 9418861. — PMC 121465.
- ↑ Amar J. Majmundar, Waihay J. Wong & M. Celeste Simon. Hypoxia-inducible factors and the response to hypoxic stress (англ.) // Molecular cell[англ.] : journal. — 2010. — October (vol. 40, no. 2). — P. 294—309. — doi:10.1016/j.molcel.2010.09.022. — PMID 20965423.
- ↑ J. Bembenek & H. Yu. Regulation of the anaphase-promoting complex by the dual specificity phosphatase human Cdc14a (англ.) // The Journal of biological chemistry : journal. — 2001. — December (vol. 276, no. 51). — P. 48237—48242. — doi:10.1074/jbc.M108126200. — PMID 11598127.
- ↑ Niels Mailand, Claudia Lukas, Brett K. Kaiser, Peter K. Jackson, Jiri Bartek & Jiri Lukas. Deregulated human Cdc14A phosphatase disrupts centrosome separation and chromosome segregation (англ.) // Nature cell biology : journal. — 2002. — April (vol. 4, no. 4). — P. 317—322. — doi:10.1038/ncb777. — PMID 11901424.
- ↑ 1 2 Спирин, 2011, с. 413.
- ↑ Спирин, 2011, с. 413—414.
- ↑ Barrett et. al., 2013, p. 19.
- ↑ Rogers, Jack T.; Bush, Ashley I.; Cho, Hyan-Hee; Smith, Deborah H.; Thomson, Andrew M.; Friedlich, Avi L.; Lahiri, Debomoy K.; Leedman, Peter J.; Huang, Xudong; Cahill, Catherine M. Iron and the translation of the amyloid precursor protein (APP) and ferritin mRNAs: Riboregulation against neural oxidative damage in Alzheimer's disease (англ.) // Biochemical Society Transactions[англ.] : journal. — 2008. — Vol. 36, no. 6. — P. 1282—1287. — doi:10.1042/BST0361282. — PMID 19021541. — PMC 2746665.
Литература
- Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка. — М.: Издательский центр «Академия», 2011. — 496 с. — ISBN 978-5-7695-6668-4.
- Lucy W. Barrett, Sue Fletcher, Steve D. Wilton. Untranslated Gene Regions and Other Non-coding Elements. — SpringerBriefs in Biochemistry and Molecular Biology, 2013. — 57 p. — ISBN 978-3-0348-0679-4.