V(D)J-рекомбинация
V(D)J-рекомбина́ция[1], или V(D)J-реаранжиро́вка[2] (англ. V(D)J-recombination, V(D)J rearrangement), — механизм соматической рекомбинации ДНК, происходящий на ранних этапах дифференцировки лимфоцитов и приводящий к формированию антиген-распознающих участков антител и Т-клеточного рецептора. Гены иммуноглобулинов[англ.] (англ. Ig) и Т-клеточных рецепторов (англ. TCR) состоят из повторяющихся сегментов, принадлежащих к трём классам: V (от англ. variable), D (от англ. diversity) и J (от англ. joining). В процессе V(D)J-перестройки генные сегменты, по одному из каждого класса, соединяются вместе. Объединённая последовательность сегментов V(D)J кодирует вариабельные домены каждой из цепей рецептора или антитела[2].
Гены иммуноглобулинов и T-клеточных рецепторов
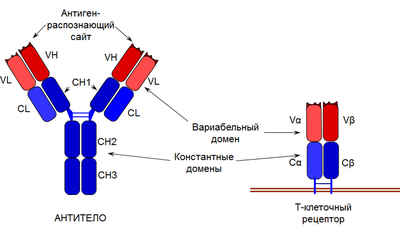
Молекула антитела (иммуноглобулина) представляет собой тетрамер из двух идентичных тяжёлых (H-цепей) и двух идентичных лёгких цепей (L-цепей). Каждая цепь имеет N-концевой вариабельный участок (вариабельный, или V-домен) и константный участок (константный, или C-домен) на C-конце. Вариабельный домен принимает участие в распознавании антигена, а C-домен отвечает за эффекторные функции. Как следует из названия, аминокислотная последовательность V-домена вариабельна, а C-домен демонстрирует выраженную консервативность. Максимальная изменчивость проявляется именно в области, ответственной за связывание антигена[3]. Антигенсвязывающий участок формируется V-доменами тяжёлых и лёгких цепей (VH- и VL-домены соответственно)[4]. L-цепь содержит один C-домен (обозначается CL), а H-цепь — 3 или 4 домена, которые обозначаются CH1, CH2, CH3, CH4. C-домены не участвуют в распознавании антигенов и необходимы для взаимодействия с рецепторами иммунных клеток, активации системы комплемента и других эффекторных функций[5].

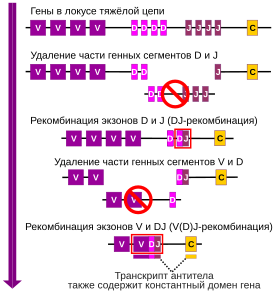
В отличие от большинства генов, гены иммуноглобулинов и T-клеточных рецепторов не присутствуют в целом виде в клетках зародышевой линии и соматических клетках. Образование единого гена, кодирующего V- и C-домены, происходит посредством одного (в случае лёгких цепей) или двух (в случае тяжёлых цепей) актов соматической рекомбинации. V-домены и C-домены кодируются отдельными сегментами V-гена и C-гена соответственно, причём они не могут экспрессироваться поодиночке: в данной системе два «гена» кодируют единый полипептид — лёгкую или тяжёлую цепь. Любой из множества сегментов V-гена может соединиться с любым из нескольких C-генных сегментов. Лёгкие цепи образуются в результате единственного акта рекомбинации. Имеется два типа лёгких цепей: κ и λ. Лёгкая цепь λ образуется при рекомбинации между Vλ-геном и сегментом JλCλ. Буквой J сокращённо обозначают участок, с которым соединяется сегмент Vλ, то есть реакция соединения происходит не напрямую между Vλ- и Cλ-сегментами, а через сегмент Jλ. Этот сегмент кодирует несколько аминокислотных остатков (а. о.) вариабельного участка и в гене, образованном рекомбинацией, сегмент Vλ-Jλ представляет собой один экзон, кодирующий весь вариабельный участок. В случае лёгкой цепи типа κ сборка цепи также осуществляется из двух сегментов, однако после гена Vκ следует группа из пяти сегментов Jκ, которая отделена от экзона Cκ интроном длиной от 2 до 3 тысяч пар нуклеотидов. В ходе рекомбинации Vκ-сегмент может соединиться с любым из Jκ-сегментов, и интактный вариабельный экзон в конечном счёте состоит из сегментов Vκ и Jκ. Jκ-сегменты, расположенные левее от рекомбинирующего Jκ-сегмента, удаляются, а Jκ-сегменты справа от рекомбинирующего сегмента становятся частью интрона между вариабельным и константным экзонами[6].
Тяжёлые цепи образуются в результате не одного, а двух актов рекомбинации, и в их образовании задействованы такие элементы, как VH-ген, D-сегмент и VHCH-генный сегмент. D-сегмент представляет собой участок из 2—13 а. о., разделяющий последовательности, которые кодирует VH-сегмент и JH-сегмент. Участок D-сегментов на хромосоме также находится между множествами VH-сегментов и JH-сегментов. Объединение VH-D-JH происходит в две стадии: сначала один из D-сегментов соединяется с JH-сегментов, а потом VH-сегмент рекомбинирует с объединённым сегментом DJH. Получившаяся последовательность из трёх элементов VH-D-JH экспрессируется совместно с геном CH, который находится справа от VH-D-JH и включает четыре экзона. У человека локус D-сегментов содержит 30 тандемно расположенных D-сегментов, а за ним располагается кластер[англ.] из 6 сегментов JH. Каким образом обеспечивается, чтобы в актах рекомбинации D-JH и VH-D-JH участвовал один и тот же D-сегмент, пока неизвестно. По названию отдельных элементов процесс сборки единого локуса, кодирующего лёгкую или тяжёлую цепь, получил название V(D)J-рекомбинации[7].
T-клеточный рецептор (англ. T cell receptor, TCR) представляет собой гетеродимер из двух субъединиц: α и β (рецептор TCRαβ) либо γ и δ (рецептор TCRγδ), которые кодируют гены TCRA, TCRB, TCRG и TCRD соответственно. Хотя последовательности, кодирующие δ-цепь ТCR, расположены внутри гена α-цепи, они обычно рассматриваются как отдельный генетический кластер. Как и в случае иммуноглобулинов, T-клеточный рецептор включает константные домены и кодирующие их C-гены, V-домены, которые кодируют V-гены, и разделяющие кластеры C-генов и V-генов J-сегменты (в генах TCRB и TCRD также присутствуют D-сегменты). При формировании каждой из четырёх возможных цепей TCR также происходит V(D)J-рекомбинация[8]. В случае генов TCRB и TRCD, содержащих сегменты D, рекомбинация происходит в два этапа (сначала между сегментами D и J, потом между DJ и сегментами V), а в случае TCRA и TRCG — в один этап[9].
Таким образом, всего семь генных локусов подвержены V(D)J-перестройке: тяжёлой цепи иммуноглобулина (IgH), лёгких цепей κ и λ, а также четыре гена Т-клеточного рецептора, кодирующих цепи α, β, γ, δ: TCRA, TCRB, TCRG и TCRD соответственно. D-сегменты имеются только в гене тяжёлой цепи иммуноглобулина, TCRB и TCRD[10].
V-гены всех полипептидных цепей, участвующих в распознавании антигена, подвергаются перестройке, но не единовременно, а последовательно. В B-клетках сначала перестраиваются гены тяжёлых цепей, а затем — лёгких цепей (сначала перестраиваются лёгкие цепи типа κ, затем — типа λ). В T-клетках при формировании генов TCRαβ сначала перестраиваются гены β-, а потом — α-цепей. В случае TCRγδ перестройка генов вариабельных доменов γ- и δ-цепей происходит почти одновременно[11].
Механизм
V(D)J-рекомбинация проходит до конца только в T- и B-клетках под влиянием сигналов дифференцировки из внешней среды. Начальные этапы перестройки в виде DJ-рекомбинации могут происходить и в клетках, не относящихся к T- и B-клеткам, например, естественных киллерах, которые по происхождению близки к T-клеткам[12]. Молекулярный механизм V(D)J-рекомбинации всех семи локусов иммуноглобулинов или T-клеточных рецепторов идентичный[13]. Последовательность реакций V(D)J-рекомбинации описана в предыдущем разделе, здесь же будут описаны молекулярные механизмы V(D)J-рекомбинации.
Рекомбинация происходит по сигнальным последовательностям ДНК, непосредственно прилегающим к генным сегментам. Эти консервативные последовательности называются сигнальные последовательности рекомбинации[англ.] (англ. recombination signal sequence, RSS) и состоят из семи нуклеотидов — 5'-CACAGTG-3' (гептамер), за которым следует последовательность из 12 или 23 нуклеотидов — спейсер, и ещё одного консервативного блока из девяти нуклеотидов — 5'-ACAAAAACC-3' (нонамер). Последовательность спейсера может варьировать, но длина консервативна и соответствует одному (12 нуклеотидов) или двум (23 нуклеотида) виткам двойной спирали ДНК. Перестройка происходит только между двумя RSS, одна из которых имеет спейсер 12 пар оснований (п. о.), другая — 23 п. о., так называемое «правило рекомбинации 12/23». Эта закономерность строения RSS определяет правильную последовательность рекомбинации: например, локус IGH имеет RSS длиной 23 п. о. на 3'-конце каждого V-сегмента, RSS длиной 12 п. о. на 3’- и 5’-конце каждого D сегмента и RSS длиной 23 п. о. на 5'-конце каждого J-сегмента. Таким образом, V-J-реаранжировка этого локуса невозможна. Порядок расположения консенсусных последовательностей у V- или J-сегментов может быть любым, то есть разные спейсеры служат лишь для предотвращения рекомбинации V- или J-сегмента с таким же сегментов и несут никакой значимой информации[14].
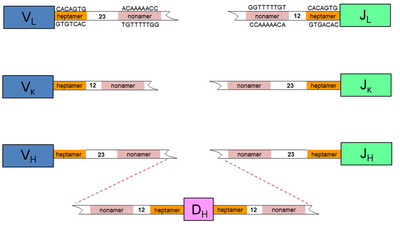
Для внесения разрывов в ДНК при V(D)J-рекомбинации необходимы и достаточны белки RAG1[англ.] и RAG2[англ.] (англ. recombination activation genes). Мыши, лишённые генов RAG1 и RAG2, имеют только незрелые T- и B-клетки, поскольку неспособны формировать функциональные антитела и T-клеточные рецепторы. RAG1 распознаёт сигнальные последовательности с соответствующими спейсерами длиной 12 или 23 п. о. и рекрутирует RAG2 в реакционный комплекс. Сигнальная последовательность из 9 п. о. является сайтом первичного распознавания, а последовательность из 7 п. о. указывает место внесения разреза. В результате димеризации RAG1 и RAG2 связанные с ними последовательности сближаются, чему также способствуют комплементарные взаимодействия между сигнальными последовательностями, которые возможны благодаря их палиндромности[англ.]. В сближении последовательностей, связанных RAG1 и RAG2, также принимает участие гетеродимер HMG1/2. Комплекс RAG1/2 вносит одноцепочечный разрыв в каждый из двух участков, которые будут соединены в результате рекомбинации. На концах каждого из двух одноцепочечных разрывов имеются 5'-концевая фосфатная группа и 3'-концевая гидроксильная группа (3'-OH). 3'-OH, которая прилегает к кодирующему сегменту, атакует фосфодиэфирную связь[англ.] в соответствующей позиции на другой стороне дуплекса ДНК. В результате этой реакции на месте каждого одноцепочечного разрыва формируется шпилька, в которой 3'-конец одной из двух цепей спирали ДНК ковалентно связана с 5'-концом второй цепи дуплекса. Шпильки на концах кодирующих сегментов распознаются гетеродимером из белков Ku70 и Ku80, а белок Artemis[англ.] раскрывает шпильки. Далее концы кодирующих сегментов соединяются по тому же механизму, что и при негомологичном соединении концов при репарации ДНК. Если недалеко от концевой шпильки происходит разрыв цепи ДНК, то на конце кодирующего сегмента формируется длительный одноцепочечный участок. Далее достраивается комплементарная к нему цепь, и в область конца кодирующего сегмента вводится несколько дополнительных нуклеотидов, которые формируют последовательность, палиндромную по отношению к исходной (поэтому их называют P-нуклеотидами от англ. palindromic). Дополнительные нуклеотиды между кодирующими сегментами могут появиться и в результате другого процесса. Фермент терминальная дезоксинуклеотидилтрансфераза (TdT) вводит небольшое количество (до 20, обычно менее 10) дополнительных случайных нуклеотидов (N-нуклеотидов) между концами сегментов, после чего они сшиваются по пути негомологичного соединения концов[15]. Вырезанный участок, содержащий сигнальные последовательности RSS, замыкается с образованием кольцевидной структуры, известной как рекомбинационное вырезанное кольцо (REC от англ. Recombination excision circle)[9].

Воссоединение концов кодирующих сегментов происходит по механизму негомологичного соединения концов при участии ферментов ДНК-лигазы IV, ДНК-зависимой протеинкиназы, белков Ku70/Ku80, XRCC4[англ.] и фактор негомологичного соединения концов 1[англ.][16]. На этом сборка гена, кодирующего цепь иммуноглобулина или TCR, завершается. ДНК-зависимая протеинкиназа участвует в активации белка Artemis, разрешающего шпильки, за счёт фосфорилирования[17]. Совокупность белков RAG1, RAG2, ДНК-зависимой протеинкиназы, ДНК-лигазы IV, TdT, HMG1/2 и Ku70/Ku80 называют V(D)J-рекомбинационным комплексом[18].
Последствия
Благодаря V(D)J-рекомбинации в организме позвоночного животного создаётся колоссальное разнообразие антител. Один только локус тяжёлых цепей может дать более 108 различных комбинаций VH-JH-CH. Локусы лёгких цепей могут дать около миллиона рекомбинированных цепей типа λ или типа κ[19]. Весь спектр антител в крови в 2008 году Джордж Чёрч предложил называть термином V(D)J-ом[20].
В некоторых случаях V(D)J-рекомбинация может приводить к возникновению инверсий или делеций. Так, иногда в локусах лёгких цепей типа λ сегмент Vλ имеет ориентацию на хромосоме, обратную ориентации локуса Jλ-Cλ, и разрыв и воссоединение в этом случае приведёт к инверсии удаляемого участка с сигнальными последовательностями вместо его вырезания из состава хромосомы (делеции). Функциональные последствия инверсии для иммунной системы не отличаются от последствий делеции. Рекомбинация посредством инверсии встречается в локусах TCR, тяжёлых цепей, а также лёгких цепей типа κ[21].
Когда перестройка конкретного V-гена завершается успешно, то экспрессия генов RAG останавливается, и ген на гомологичной хромосоме остаётся неперестроенным и не функционирует. Примерно две трети неудачных случаев V(D)J-рекомбинации связаны со сдвигом рамки считывания. В случае, если перестройка оканчивается неудачей, V(D)J-рекомбинация начинается на гомологичной хромосоме и при её успешном завершении ген на гомологичной хромосоме остаётся единственным функционирующим, то есть происходит аллельное исключение. В 45 % случаев V(D)J-рекомбинация происходит неудачно на обеих хромосомах лимфоцита, и он погибает апоптозом. В случае αβ-TCR при неудачной перестройке гена α-цепи процесс редактирования перезапускается и ген RAG экспрессируется повторно. Рекомбинация продолжается с участием Vα-сегмента, который не был вырезан из хромосомы и не попал в эксцизионное кольцо. Процесс может повторяться до образования функционального гена, кодирующего лёгкую цепь. При беременности или при распознавании T-клеткой аутоантигена может происходить редактирование гена α-цепи. Если редактируется ген α-цепи, который находится в зародышевой конфигурации на второй хромосоме из пары гомологов, то может возникнуть ситуация, нарушающая правило аллельного исключения: в одной T-клетке будет присутствовать два TCR с одинаковыми β-цепями, но разными α-цепями[22].
Нарушения V(D)J-рекомбинации приводят к развитию иммунодефицитных состояний. При синдроме тяжёлого комбинированного иммунодефицита уровень V(D)J-рекомбинации в локусах, кодирующих иммуноглобулины и T-клеточные рецепторы, очень низок. Причиной синдрома тяжёлого комбинированного иммунодефицита являются мутации, которые делают нефункциональными белки V(D)J-рекомбинаци: RAG1, RAG2, Artemis или ДНК-зависимую протеинкиназу[23][17].
История изучения
На основании данных о наличии константных и вариабельных доменов в молекуле иммуноглобулина Дрейер и Беннет в 1965 году высказали предположение о том, что в построении единой тяжёлой или лёгкой цепи иммуноглобулина участвуют два гена — V и C[24]. В 1976 году Судзуми Тонегава начал серию экспериментов и показал, что гены, кодирующие антитела, претерпевают перестройки, за счёт которых создаётся огромное разнообразие антител[25]. В 1987 году Тонегава получил Нобелевскую премию по физиологии и медицине за открытие механизмов разнообразия антител[26].
Примечания
- ↑ Д. Мейл, Д. Бростофф, Д. Рот, А. Ройтт. Иммунология. — 7 (оригинальное). — Москва: Логосфера, 2007. — С. 105. — 568 с. — ISBN 9785986570105.
- ↑ 1 2 Ярилин, 2010, с. 254—259.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 460—461.
- ↑ Ярилин, 2010, с. 239.
- ↑ Ярилин, 2010, с. 232.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 460—463.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 463—464.
- ↑ Ярилин, 2010, с. 252—253.
- ↑ 1 2 Ярилин, 2010, с. 255.
- ↑ Krangel M. S. Gene segment selection in V(D)J recombination: accessibility and beyond. (англ.) // Nature Immunology. — 2003. — July (vol. 4, no. 7). — P. 624—630. — doi:10.1038/ni0703-624. — PMID 12830137.
- ↑ Ярилин, 2010, с. 258.
- ↑ Ярилин, 2010, с. 257.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 465.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 465—466.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 469—470.
- ↑ Gauss G. H., Lieber M. R. Mechanistic constraints on diversity in human V(D)J recombination. (англ.) // Molecular And Cellular Biology. — 1996. — January (vol. 16, no. 1). — P. 258—269. — doi:10.1128/mcb.16.1.258. — PMID 8524303.
- ↑ 1 2 Кребс, Голдштейн, Килпатрик, 2017, с. 470.
- ↑ Ярилин, 2010, с. 255—256.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 464.
- ↑ HGM2008 new technologies: genome sequencing to molecular imaging symposium abstracts (англ.) // Genomic Medicine. — 2008. — December (vol. 2, no. 3-4). — P. 149—150. — ISSN 1871-7934. — doi:10.1007/s11568-009-9110-9.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 466—467.
- ↑ Ярилин, 2010, с. 257—258.
- ↑ Abbas, Lichtman, Pillai, 2015, p. 182.
- ↑ Галактионов, 2004, с. 75.
- ↑ Hozumi N., Tonegawa S. Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1976. — October (vol. 73, no. 10). — P. 3628—3632. — doi:10.1073/pnas.73.10.3628. — PMID 824647.
- ↑ The MIT 150: 150 Ideas, Inventions, and Innovators that Helped Shape Our World. The Boston Globe (15 мая 2011). Дата обращения: 8 августа 2011. Архивировано 4 марта 2016 года.
Литература
- Галактионов В. Г. Иммунология. — М.: Издат. центр «Академия», 2004. — 528 с. — ISBN 5-7695-1260-1.
- Кребс Дж., Голдштейн Э., Килпатрик С. Гены по Льюину. — М.: Лаборатория знаний, 2017. — 919 с. — ISBN 978-5-906828-24-8.
- Ярилин А. А. Иммунология. — М.: ГЭОТАР-Медиа, 2010. — 752 с. — ISBN 978-5-9704-1319-7.
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology. — Philadelphia: Elsevier Saunders, 2015. — ISBN 978-0-323-22275-4.