
Хи́мия — одна из важнейших и обширных областей естествознания, наука, изучающая вещества, также их состав и строение, их свойства, зависящие от состава и строения, их превращения, ведущие к изменению состава — химические реакции, а также законы и закономерности, которым эти превращения подчиняются. Поскольку все вещества состоят из атомов, которые благодаря химическим связям способны формировать молекулы, то химия занимается, прежде всего, рассмотрением перечисленных выше задач на атомно-молекулярном уровне, то есть на уровне химических элементов и их соединений. Химия имеет немало связей с физикой и биологией, по сути граница между ними условна, а пограничные области изучаются квантовой химией, химической физикой, физической химией, геохимией, биохимией и другими науками. Является экспериментальной наукой.

Моле́кула — электрически нейтральная частица, образованная из двух или более связанных атомов.

Органи́ческая хи́мия — раздел химии, изучающий структуру, свойства и методы синтеза соединений углерода с другими химическими элементами, относящихся к органическим соединениям. Первоначальное значение термина органическая химия подразумевало изучение только соединений углерода растительного и животного происхождения. По этой причине ряд углеродсодержащих соединений традиционно не относят к органическим, а рассматривают как неорганические соединения. Условно можно считать, что структурным прототипом органических соединений являются углеводороды.

Физи́ческая хи́мия — раздел химии, наука об общих законах строения, структуры и превращения химических веществ. Исследует химические явления с помощью теоретических и экспериментальных методов физики. Наиболее обширный раздел химии.
Ква́нтовая хи́мия — направление теоретической химии, рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики. Разделами квантовой химии являются: квантовая теория строения молекул, квантовая теория химических связей и межмолекулярных взаимодействий, квантовая теория химических реакций и реакционной способности и др. Она занимается рассмотрением химических и физических свойств веществ на атомарном уровне. Вследствие того, что сложность изучаемых объектов во многих случаях не позволяет находить явные решения уравнений, описывающих процессы в химических системах, применяют приближенные методы расчета. С квантовой химией неразрывно связана вычислительная химия — дисциплина, использующая математические методы квантовой химии, адаптированные для создания специальных компьютерных программ, используемых для расчета молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, симуляции взаимодействия молекул.
Химическая связь — взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами. Современное описание химической связи проводится на основе квантовой механики. Основные характеристики химической связи — прочность, длина, полярность, устойчивость.
Хими́ческая фо́рмула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков. Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура веществ. Одним из первых начал использовать их русский химик А. А. Иовский.

Теория молекулярных орбиталей (МО) даёт представление о распределении электронной плотности и объясняет свойства молекул.
Теория химического строения — учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т. д.

Вале́нтность — способность атомов образовывать определённое количество химических связей, которые образует атом, или число атомов, которое может присоединить или заместить атом данного элемента.

Ковале́нтная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
А́том водоро́да — физико-химическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра, как правило, входит протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон образует электронную оболочку; наибольшая вероятность обнаружения электрона в единичном объёме наблюдается для центра атома. Интегрирование по сферическому слою показывает, что наибольшая вероятность обнаружения электрона в единичном слое соответствует среднему радиусу, равному боровскому радиусу  ангстрема.
ангстрема.

Гибридиза́ция орбита́лей — процесс смешения различных атомных орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим правилам. Угол между гибридными орбиталями при sp3-гибридизации равен 109.5°, при sp2 — 120°, при sp — 180°.

Норма́льные колеба́ния, со́бственные колебания или мо́ды — набор характерных для колебательной системы типов гармонических колебаний. Каждое из нормальных колебаний физической системы, например, колебаний атомов в молекулах, характеризуется своей частотой. Такая частота называется нормальной частотой, или собственной частотой. Набор частот нормальных колебаний составляет колебательный спектр. Произвольное колебание физической системы можно представить в виде суперпозиции различных нормальных колебаний. Вынужденные колебания физической системы испытывают резонанс на частотах, которые совпадают с частотами нормальных колебаний этой системы.
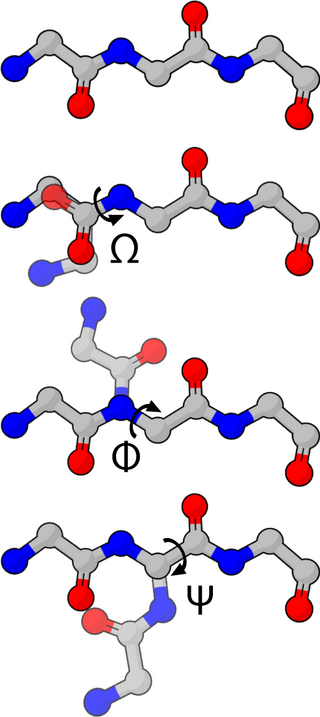
Молекулярное моделирование (ММ) — собирательное название методов исследования структуры и свойств молекул вычислительными методами с последующей визуализацией результатов, обеспечивающие их трехмерное представления при заданных в расчете условиях.
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.

Молекулярные орбитали — математическая функция, описывающая волновое поведение электронов в молекуле.

Поверхность потенциальной энергии применяется для описания энергии системы, в особенности множества атомов, в терминах определённых параметров, обычно — координат атомов. Поверхность может определять энергию как функцию одной или нескольких координат. Если координата только одна, то поверхность называется кривой потенциальной энергии или профилем энергии.

Молекулярная симметрия — это фундаментальная концепция химии, описывающая и классифицирующая симметрию молекулы, используемая для предсказания или объяснения химических свойств молекул. Например, таких как дипольный момент и разрешённые спектроскопические переходы. Изучение молекулярной симметрии основано на теории групп. Состояние молекулы классифицируется с помощью неприводимых представлений из таблицы характеров группы симметрии молекулы.


















