Протео́мика — область молекулярной биологии, посвящённая идентификации и количественному анализу белков. Термин «протеомика» был предложен в 1997 году. Совокупность всех белков клетки называют протеомом.

Митохо́ндрия — двумембранная сферическая или эллипсоидная органелла диаметром обычно около 1 микрометра. Характерна для большинства эукариотических клеток, как автотрофов, так и гетеротрофов. Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза АТФ и термогенеза. Эти три процесса осуществляются за счёт движения электронов по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют. В специализированных клетках органов животных содержатся сотни и даже тысячи митохондрий.

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
Секвени́рование биополимеров — определение их аминокислотной или нуклеотидной последовательности. В результате секвенирования получают формальное описание первичной структуры линейной макромолекулы в виде последовательности мономеров в текстовом виде. Размеры секвенируемых участков ДНК обычно не превышают 100 пар нуклеотидов и 1000 пар нуклеотидов при секвенировании по Сенгеру. В результате секвенирования перекрывающихся участков ДНК получают последовательности участков генов, целых генов, тотальной мРНК или полных геномов организмов.

Плазми́ды — небольшие молекулы ДНК, физически обособленные от хромосом и способные к автономной репликации. Главным образом плазмиды встречаются у бактерий, а также у некоторых архей и эукариот. Чаще всего плазмиды представляют собой двухцепочечные кольцевые молекулы. Несмотря на способность к размножению, плазмиды, как и вирусы, не рассматриваются в качестве живых организмов.

Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью. Данный способ фракционирования белков и пептидов широко применяют в современной молекулярной биологии, биохимии, генетике.
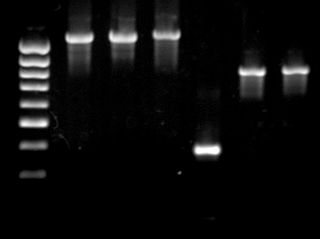
Электрофорез ДНК в агарозном геле — аналитический метод, применяемый для разделения фрагментов ДНК по длине. Основан на разной скорости движения фрагментов разной длины при движении в геле под действием внешнего электрического поля.
Электрофорез в полиакриламидном геле — метод молекулярной биологии и биохимии, используемый для разделения белков и нуклеиновых кислот, основанный на движении заряженных биологических макромолекул в постоянном электрическом поле. Разделение в полиакриламидном геле происходит за счёт различий заряда разделяемых молекул и отличий молекулярных масс, а также от конфигурации молекул. Различают т. н. неденатурирующий, или нативный ПААГ-электрофорез и денатурирующий ПААГ-электрофорез. В процессе денатурирующего ПААГ-электрофореза молекулы сохраняются в денатурированном состоянии за счёт наличия в геле хаотропных агентов в случае ПААГ-электрофореза нуклеиновых кислот и белков и наличия ионных и неионных детергентов.
- В случае электрофореза белков в полиакриламидном геле метод обычно используют в модификации Леммли (Laemmli)
- Также электрофорез в полиакриламидном геле применяют для разделения коротких фрагментов нуклеиновых кислот, например, ДНК-электрофорез, например, при секвенировании по Сэнгеру. Кроме этого, ПААГ-электрофорез применяют для визуализации в методах ПДРФ и ПЦР.
- Различают также т. н. диск-электрофорез, при котором в геле в процессе электрофоретического разделения белков на границе между концентрирующим и разделяющим гелями создаётся градиент pH, за счёт чего достигается лучшее разделение белковых молекул.

Са́узерн-блот, Са́узерн-бло́ттинг, бло́ттинг по Са́узерну, блот Са́зерна, бло́ттинг Са́зерна, са́зерн-блот, са́зерн-бло́ттинг — метод, применяемый в молекулярной биологии для выявления определённой последовательности ДНК в образце. Он заключается в переносе разделённых электрофорезом в агарозном геле фрагментов ДНК на мембранный фильтр и последующем обнаружении в них известной последовательности из ДНК-зонда с помощью гибридизации с ним. Метод называется по имени изобретателя, английского биолога Эдвина Саузерна.

ДНК-микрочип, или ДНК-чип — технология, используемая в молекулярной биологии и медицине. ДНК-микрочип представляет собой множество небольших одноцепочечных молекул — ДНК-зондов, которые ковалентно пришиты к твёрдому основанию. Каждый такой зонд имеет строго определённую последовательность нуклеотидов и место на микрочипе. Одинаковые зонды располагаются вместе, образуя сайт микрочипа. Между сайтом и последовательностью ДНК зонда есть взаимно-однозначное соответствие. ДНК-микрочипы используются для определения ДНК или РНК, которые могут быть как белок-кодирующими, так и не кодировать белки. Измерение генной экспрессии посредством кДНК называется профилем экспрессии, или экспрессионным анализом. На современных микрочипах можно полностью расположить целый геном, каждый известный ген которого будет являться зондом.
Футпринтинг ДНК — метод поиска в структуре ДНК последовательностей связывания ДНК-связывающих белков. Данный метод используют для изучения взаимодействия белков с ДНК как in vitro, так и in vivo.
Вестерн-блоттинг — аналитический метод, используемый для определения в образце специфичных белков. На первом этапе используют электрофорез белков в полиакриламидном геле для разделения денатурированных полипептидов по длине или по трехмерной структуре белка. Далее белки переносят на нитроцеллюлозную или PVDF-мембрану, затем детектируют с использованием антител, специфичных к заданному белку.
ДНК-дактилоскопи́я или Генети́ческая дактилоскопи́я, ДНК-тест — система научных методов биологической идентификации индивидуумов (организмов) на основе уникальности последовательности нуклеотидов ДНК каждого живого существа, своеобразного «генетического отпечатка», остающегося индивидуальным и неизменным на протяжении всей жизни индивидуума (организма).

Нозерн-блот — метод исследования экспрессии генов путём тестирования молекул РНК (мРНК) и их фрагментов в образцах.

Сэр Эдвин Мэллор Садерн — британский молекулярный биолог.
DNase-Seq или определение чувствительности к ДНКазе — это молекулярно-биологический метод, наряду с FAIRE-Seq, используемый для определения положения регуляторных регионов. Метод основан на секвенировании областей, гиперчувствительных к расщеплению ДНКазой I. DNase-Seq используется для определения глобального распределения сайтов расщепления ДНКазой I и, следовательно, открытого хроматина, в котором часто и локализованы регуляторные элементы. DNase-Seq является особенно привлекательным для идентификации регуляторных элементов, так как не полагается на наличие или специфичность антител.

Coomassie Brilliant Blue — название двух близких трифенилметановых красителей, разработанных для текстильной индустрии, но в настоящее время широко используемых в аналитической биохимии для окраски белков. Coomassie Brilliant Blue G-250 отличается от R-250 наличием двух метильных групп. Название «Coomassie» — зарегистрированный товарный знак Imperial Chemical Industries.
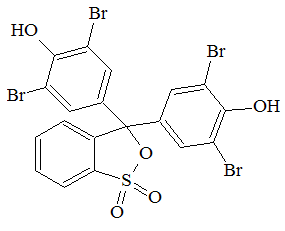
Бромфеноловый синий натуральный краситель, также применяемый в лабораторной практике как pH-индикатор и маркёр при проведении электрофореза.
Электрофорез двумерный — процесс разделения сложных связей белков, в котором сочетаются электрофорез белков и изоэлектрическое фокусирование. Метод позволяет изучать структуры, возникающие в сверхспирализованной молекуле кольцевой ДНК.









