Гистондеацетилаза 8
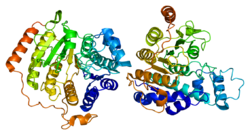
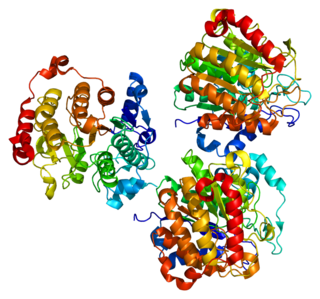
Гистондеацетилаза 8 (англ. Histone deacetylase 8) — фермент, кодируемый у человека геном HDAC8 [5][6][7].
Функция
Гистоны играют важнейшую роль в регуляции транскрипции, прогрессировании клеточного цикла и процессов развития. Ацетилирование/деацетилирование гистонов изменяет хромосомную структуру и влияет на доступ факторов транскрипции к ДНК. Белок, кодируемый этим геном относится к классу I в семействе гистондезацетилазы/acuc/Apha. Он обладает деятельностью гистондеацетилазы и подавляет транскрипцию, когда связан с промотором[7].
Гистондеацетилаза 8 участвует в морфогенезе черепа[8] и метаболическом контроле над комплексом транскрипции ERR-альфа[англ.]/PGC1-alpha[англ.][9].
Клиническое значение
HDAC8 был связан с некоторым числом болезненных состояний, в частности, с острым миелоидным лейкозом, а также связан с актиновым цитоскелетом в клетках гладких мышц. миРНК ориентированные на HDAC8 показали противораковые эффекты[10]. Ингибирование индуцированного апоптоза посредством HDAC8 наблюдается при Т-клеточных лимфомах[англ.][11]. Кроме того фермент HDAC8 участвует в патогенезе нейробластомы[12]. Таким образом, существует интерес к разработке селективных ингибиторов на базе HDAC8[13][14].
Взаимодействия
См. также
Примечания
- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000147099 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000067567 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ McDonell N., Ramser J., Francis F., Vinet M.C., Rider S., Sudbrak R., Riesselman L., Yaspo M.L., Reinhardt R., Monaco A.P., Ross F., Kahn A., Kearney L., Buckle V., Chelly J. Characterization of a highly complex region in Xq13 and mapping of three isodicentric breakpoints associated with preleukemia (англ.) // Genomics : journal. — Academic Press, 2000. — May (vol. 64, no. 3). — P. 221—229. — doi:10.1006/geno.2000.6128. — PMID 10756090.
- ↑ Van den Wyngaert I., de Vries W., Kremer A., Neefs J., Verhasselt P., Luyten W.H., Kass S.U. Cloning and characterization of human histone deacetylase 8 (англ.) // FEBS Lett[англ.] : journal. — 2000. — August (vol. 478, no. 1—2). — P. 77—83. — doi:10.1016/S0014-5793(00)01813-5. — PMID 10922473.
- ↑ 1 2 Entrez Gene: HDAC8 histone deacetylase 8.
- ↑ Haberland M., Mokalled M.H., Montgomery R.L., Olson E.N. Epigenetic control of skull morphogenesis by histone deacetylase 8 (англ.) // Genes Dev. : journal. — 2009. — July (vol. 23, no. 14). — P. 1625—1630. — doi:10.1101/gad.1809209. — PMID 19605684. — PMC 2714711.
- ↑ 1 2 Wilson B.J., Tremblay A.M., Deblois G., Sylvain-Drolet G., Giguère V. An acetylation switch modulates the transcriptional activity of estrogen-related receptor alpha (англ.) // Mol. Endocrinol.[англ.] : journal. — 2010. — July (vol. 24, no. 7). — P. 1349—1358. — doi:10.1210/me.2009-0441. — PMID 20484414.
- ↑ Gallinari P., Di Marco S., Jones P., Pallaoro M., Steinkühler C. HDACs, histone deacetylation and gene transcription: from molecular biology to cancer therapeutics (англ.) // Cell Res.[англ.] : journal. — 2007. — March (vol. 17, no. 3). — P. 195—211. — doi:10.1038/sj.cr.7310149. — PMID 17325692.
- ↑ Balasubramanian S., Ramos J., Luo W., Sirisawad M., Verner E., Buggy J.J. A novel histone deacetylase 8 (HDAC8)-specific inhibitor PCI-34051 induces apoptosis in T-cell lymphomas (англ.) // Leukemia : journal. — 2008. — May (vol. 22, no. 5). — P. 1026—1034. — doi:10.1038/leu.2008.9. — PMID 18256683.
- ↑ Oehme I., Deubzer H.E., Wegener D., Pickert D., Linke J.P., Hero B., Kopp-Schneider A., Westermann F., Ulrich S.M., von Deimling A., Fischer M., Witt O. Histone deacetylase 8 in neuroblastoma tumorigenesis (англ.) // Clin. Cancer Res.[англ.] : journal. — 2009. — January (vol. 15, no. 1). — P. 91—9. — doi:10.1158/1078-0432.CCR-08-0684. — PMID 19118036.
- ↑ Patil V., Sodji Q.H., Kornacki J.R., Mrksich M., Oyelere A.K. 3-Hydroxypyridin-2-thione as novel zinc binding group for selective histone deacetylase inhibition (англ.) // Journal of Medicinal Chemistry[англ.] : journal. — 2013. — May (vol. 56, no. 9). — P. 3492—3506. — doi:10.1021/jm301769u. — PMID 23547652.
- ↑ Suzuki T., Ota Y., Ri M., Bando M., Gotoh A., Itoh Y., Tsumoto H., Tatum P.R., Mizukami T., Nakagawa H., Iida S., Ueda R., Shirahige K., Miyata N. Rapid discovery of highly potent and selective inhibitors of histone deacetylase 8 using click chemistry to generate candidate libraries (англ.) // Journal of Medicinal Chemistry[англ.] : journal. — 2012. — November (vol. 55, no. 22). — P. 9562—9575. — doi:10.1021/jm300837y. — PMID 23116147.
Литература
- Waltregny D., De Leval L., Glénisson W., Ly Tran S., North B.J., Bellahcène A., Weidle U., Verdin E., Castronovo V. Expression of histone deacetylase 8, a class I histone deacetylase, is restricted to cells showing smooth muscle differentiation in normal human tissues. (англ.) // Am J Pathol. : journal. — 2004. — Vol. 165, no. 2. — P. 553—564. — doi:10.1016/S0002-9440(10)63320-2. — PMID 15277229. — PMC 1618574.
- Glénisson W., Waltregny D., Tran S.L., North B.J., Verdin E., Colige A., Castronovo V. Histone deacetylase HDAC8 associates with smooth muscle alpha-actin and is essential for smooth muscle cell contractility. (англ.) // The FASEB Journal[англ.] : journal. — Federation of American Societies for Experimental Biology[англ.], 2005. — June (vol. 19, no. 8). — P. 966—968. — doi:10.1096/fj.04-2303fje. — PMID 15772115.
- Wedel T., Van Eys G.J., Waltregny D., Glénisson W., Castronovo V., Vanderwinden JM. Novel smooth muscle markers reveal abnormalities of the intestinal musculature in severe colorectal motility disorders. (англ.) // Neurogastroenterol Motil. : journal. — 2006. — Vol. 18, no. 7. — P. 526—538. — doi:10.1111/j.1365-2982.2006.00781.x. — PMID 16771768.
- Verdin E., Dequiedt F., Kasler H.G. Class II histone deacetylases: versatile regulators. (англ.) // Trends Genet.[англ.] : journal. — 2003. — Vol. 19, no. 5. — P. 286—293. — doi:10.1016/S0168-9525(03)00073-8. — PMID 12711221.
- Hu E., Chen Z., Fredrickson T., et al. Cloning and characterization of a novel human class I histone deacetylase that functions as a transcription repressor. (англ.) // J. Biol. Chem. : journal. — 2000. — Vol. 275, no. 20. — P. 15254—15264. — doi:10.1074/jbc.M908988199. — PMID 10748112.
- Buggy J.J., Sideris M.L., Mak P., et al. Cloning and characterization of a novel human histone deacetylase, HDAC8. (англ.) // Biochem. J.[англ.] : journal. — 2001. — Vol. 350, no. 1. — P. 199—205. — doi:10.1042/0264-6021:3500199. — PMID 10926844. — PMC 1221242.
- Amann J.M., Nip J., Strom D.K., et al. ETO, a target of t(8;21) in acute leukemia, makes distinct contacts with multiple histone deacetylases and binds mSin3A through its oligomerization domain. (англ.) // Mol. Cell. Biol. : journal. — 2001. — Vol. 21, no. 19. — P. 6470—6483. — doi:10.1128/MCB.21.19.6470-6483.2001. — PMID 11533236. — PMC 99794.
- Strausberg R.L., Feingold E.A., Grouse L.H., et al. Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2003. — Vol. 99, no. 26. — P. 16899—16903. — doi:10.1073/pnas.242603899. — PMID 12477932. — PMC 139241.
- Durst K.L., Lutterbach B., Kummalue T., et al. The inv(16) fusion protein associates with corepressors via a smooth muscle myosin heavy-chain domain. (англ.) // Mol. Cell. Biol. : journal. — 2003. — Vol. 23, no. 2. — P. 607—619. — doi:10.1128/MCB.23.2.607-619.2003. — PMID 12509458. — PMC 151524.
- Rodriguez M., Yu X., Chen J., Songyang Z. Phosphopeptide binding specificities of BRCA1 COOH-terminal (BRCT) domains. (англ.) // J. Biol. Chem. : journal. — 2004. — Vol. 278, no. 52. — P. 52914—52918. — doi:10.1074/jbc.C300407200. — PMID 14578343.
- Johnson J.M., Castle J., Garrett-Engele P., et al. Genome-wide survey of human alternative pre-mRNA splicing with exon junction microarrays. (англ.) // Science : journal. — 2004. — Vol. 302, no. 5653. — P. 2141—2144. — doi:10.1126/science.1090100. — PMID 14684825.
- Lee H., Rezai-Zadeh N., Seto E. Negative regulation of histone deacetylase 8 activity by cyclic AMP-dependent protein kinase A. (англ.) // Mol. Cell. Biol. : journal. — 2004. — Vol. 24, no. 2. — P. 765—773. — doi:10.1128/MCB.24.2.765-773.2004. — PMID 14701748. — PMC 343812.
- Vannini A., Volpari C., Filocamo G., et al. Crystal structure of a eukaryotic zinc-dependent histone deacetylase, human HDAC8, complexed with a hydroxamic acid inhibitor. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. — Vol. 101, no. 42. — P. 15064—15069. — doi:10.1073/pnas.0404603101. — PMID 15477595. — PMC 524051.
- Waltregny D., North B., Van Mellaert F., et al. Screening of histone deacetylases (HDAC) expression in human prostate cancer reveals distinct class I HDAC profiles between epithelial and stromal cells. (англ.) // European Journal of Histochemistry : journal. — 2005. — Vol. 48, no. 3. — P. 273—290. — PMID 15590418.
- Waltregny D., Glénisson W., Tran S.L., et al. Histone deacetylase HDAC8 associates with smooth muscle alpha-actin and is essential for smooth muscle cell contractility. (англ.) // The FASEB Journal[англ.] : journal. — Federation of American Societies for Experimental Biology[англ.], 2006. — Vol. 19, no. 8. — P. 966—968. — doi:10.1096/fj.04-2303fje. — PMID 15772115.
- Gantt S.L., Gattis S.G., Fierke C.A. Catalytic activity and inhibition of human histone deacetylase 8 is dependent on the identity of the active site metal ion. (англ.) // Biochemistry : journal. — 2006. — Vol. 45, no. 19. — P. 6170—6178. — doi:10.1021/bi060212u. — PMID 16681389.
- Lee H., Sengupta N., Villagra A., et al. Histone deacetylase 8 safeguards the human ever-shorter telomeres 1B (hEST1B) protein from ubiquitin-mediated degradation. (англ.) // Mol. Cell. Biol. : journal. — 2006. — Vol. 26, no. 14. — P. 5259—5269. — doi:10.1128/MCB.01971-05. — PMID 16809764. — PMC 1592721.
- Vannini A., Volpari C., Gallinari P., et al. Substrate binding to histone deacetylases as shown by the crystal structure of the HDAC8-substrate complex. (англ.) // EMBO Reports[англ.] : journal. — 2007. — Vol. 8, no. 9. — P. 879—884. — doi:10.1038/sj.embor.7401047. — PMID 17721440. — PMC 1973954.
- Nakagawa M., Oda Y., Eguchi T., et al. Expression profile of class I histone deacetylases in human cancer tissues. (англ.) // Oncol. Rep.[англ.] : journal. — 2007. — Vol. 18, no. 4. — P. 769—774. — doi:10.3892/or.18.4.769. — PMID 17786334.