
Аминокисло́ты, также аминокарбо́новые кисло́ты, АМК — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот . Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.

Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию сложных эфиров фосфорной кислоты:
- АТФ + R-OH → АДФ + R-OPO3H2

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
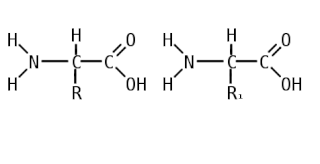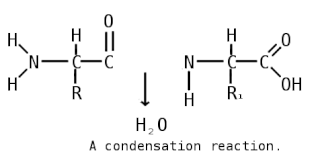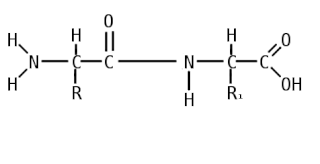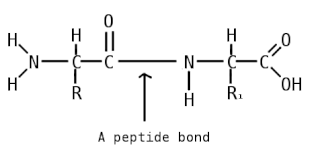
Пепти́ды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями −C(O)NH−. Обычно подразумеваются пептиды, состоящие из  -аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.
-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.

Аспараги́н — амид аспарагиновой кислоты. Одна из 20 наиболее распространённых аминокислот природного происхождения. Их кодоны AAU и AAC.
Протеа́зы, протеиназы, протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь —СО—NH— между аминокислотами в белках. Делятся на две группы:
- экзопротеазы — выделяются организмом во внешнюю среду ;
- эндопротеазы — находятся внутри клеток.
Вторичная структура — конформационное расположение главной цепи макромолекулы, независимо от конформации боковых цепей или отношения к другим сегментам. В описании вторичной структуры важным является определение водородных связей, которые стабилизируют отдельные фрагменты макромолекул.
Аминоацил-тРНК-синтетаза (АРСаза) — фермент (синтетаза), катализирующий образование аминоацил-тРНК в реакции этерификации определённой аминокислоты с соответствующей ей молекулой тРНК. Для каждой протеиногенной аминокислоты существует по меньшей мере одна аминоацил-тРНК-синтетаза.

β-Лист — одна из форм регулярной вторичной структуры белков, немного более редкая, чем альфа-спираль. Бета-листы состоят из бета-цепей (нитей), связанных с боков двумя или тремя водородными связями, образуя слегка закрученные, складчатые листы.
Предсказа́ние структу́ры белка́ — направление молекулярного моделирования, предсказание по аминокислотной последовательности трёхмерной структуры белка. Данная задача является одной из самых важных целей биоинформатики и теоретической химии. Данные, полученные при помощи предсказания, применяются в медицине и биотехнологии при создании новых ферментов. Для лучших результатов сочетают несколько программ и методов.

Протеолиз — процесс гидролиза белков, катализируемый ферментами пептидгидролазами, или протеазами.

Карнитин-О-ацетилтрансфераза, также Карнитин-ацетилтрансфераза, сокр. КАТ (англ. Carnitine O-acetyltransferase, сокр. CRAT) — фермент (КФ 2.3.1.7), из семейства ацилтрансферазы (класс трансферазы), катализирующий перенос ацетильной группы (СH3-CO) от молекулы ацетил-КоА на молекулу субстрата — карнитина и обратно, когда субстратом уже служит кофермент А, по уравнению:
Протеаза TEV — высокоспецифичная цистеиновая протеаза вируса гравировки табака. Относится к суперсемейству PA из химотрипсин-подобных протеаз. Благодаря своей высокой специфичности к последовательности часто используется для контролируемого расщепления гибридных белков in vitro и in vivo.

АДФ-рибозили́рование — химическая реакция присоединения одного или нескольких остатков АДФ-рибозы к белку. Это обратимая посттрансляционная модификация, которая играет важную роль во многих клеточных процессах, таких как передача сигнала, репарация ДНК, регуляция экспрессии генов и апоптоз. Неправильное АДФ-рибозилирование наблюдается при некоторых формах рака. Многие бактериальные токсины, такие как холерный токсин и дифтерийный токсин, влияют на АДФ-рибозилирование.
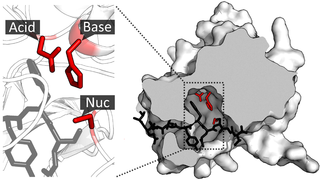
Каталитическая триада — это набор из трех скоординированных аминокислот, которые можно найти в активном центре некоторых ферментов. Каталитические триады чаще всего встречаются в ферментах гидролаз и трансфераз. Триада кислота-основание-нуклеофил является распространенным мотивом для образования нуклеофильного остатка для ковалентного катализа. Остатки образуют сеть реле заряда для поляризации и активации нуклеофила, который атакует субстрат, образуя ковалентный промежуточный продукт, который затем гидролизуется с высвобождением продукта и регенерацией свободного фермента. Нуклеофилом чаще всего является аминокислота серин или цистеин, но иногда треонин или даже селеноцистеин. Трехмерная структура фермента объединяет триадные остатки в точной ориентации, даже если они могут находиться далеко друг от друга в последовательности.
Бета-выпуклость может быть описана как локализованное нарушение регулярной водородной связи бета-листа путем вставки дополнительных аминокислотных остатков в одну или обе водородные связи β-цепей.

Спираль 310 (спираль 3.10) — тип вторичной структуры, встречающийся в белках и полипептидах. Из множества присутствующих вторичных структур белка 310-спираль является четвёртым наиболее часто наблюдаемым типом после α-спиралей, β-листов и β-поворотов. 310-спирали составляют почти 15-20 % от всех спиралей во вторичных структурах белков и обычно наблюдаются как продолжения α-спиралей, обнаруживаемые либо на их N-, либо на C-концах. 310-спирали в белках обычно имеют длину всего от трёх до пяти остатков по сравнению со средним значением 10-12 остатков для α-спиралей. Из-за тенденции α-спиралей к последовательному сворачиванию и разворачиванию было предложено, что 310-спираль служит своего рода промежуточной конформацией при сворачивании/разворачивании α-спиралей.

Пи-спираль — это тип вторичной структуры, обнаруженной в белках. Открытые кристаллографом Барбарой Лоу в 1952 году и когда-то считавшиеся редкостью, короткие π-спирали обнаруживаются в 15 % известных белковых структур и считаются эволюционной адаптацией, полученной путем вставки одной аминокислоты в α-спираль. Поскольку такие вставки сильно дестабилизируют белковую цепь, образование π-спиралей будет иметь тенденцию быть подверженными эволюционному отбору, если только это не обеспечит некоторые функциональные преимущества для белка. Следовательно, π-спирали обычно находятся рядом с функциональными сайтами белков.
Полипролиновая спираль — это тип вторичной структуры белка, который встречается в последовательностях аминокислот, содержащих повторяющиеся остатки пролина. Левозакрученная спираль полипролина II образуется, когда все последовательные аминокислотные остатки принимают двугранные углы основной цепи примерно и имеют транс- изомеры своих пептидных связей. Эта конформация PPII также характерна для белков и полипептидов с другими аминокислотами, кроме пролина. Аналогичным образом, более компактная правозакрученная спираль полипролина I образуется, когда все последовательные остатки принимают двугранные углы основной цепи примерно и имеют цис- изомеры своих пептидных связей. Из двадцати обычных встречающихся в природе аминокислот только пролин, вероятно, принимает цис- изомер пептидной связи, особенно пептидную связь X-Про; стерические и электронные факторы в значительной степени благоприятствуют транс- изомеру в большинстве других пептидных связей. Однако пептидные связи, которые заменяют пролин другой N- замещенной аминокислотой, также могут принимать цис- изомер.














