Дибензотиофен
| Дибензотиофен[1][2] | |
|---|---|
 | |
| Общие | |
| Сокращения | DBT |
| Хим. формула | C12H8S |
| Физические свойства | |
| Состояние | бесцветное твёрдое вещество |
| Молярная масса | 184,26 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 99-100 °C |
| • кипения | 332–333 °C |
| Классификация | |
| Рег. номер CAS | 132-65-0 |
| PubChem | 24893734 |
| Рег. номер EINECS | 205-072-9 |
| SMILES | |
| InChI | |
| RTECS | HQ3490550 |
| ChEBI | 23681 |
| ChemSpider | 2915 |
| Безопасность | |
| Краткие характер. опасности (H) | H302, H410 |
| Меры предостор. (P) | P273, P301+P312+P330 |
| Сигнальное слово | Осторожно |
| Пиктограммы СГС | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дибензотиофен — органическое гетероциклическое вещество, состоящее из трёх конденсированных циклов: одного тиофенового и двух бензольных.
Получение
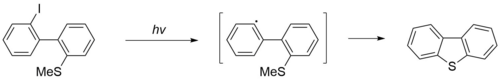
Дибензотиофен коммерчески доступен, однако его можно также синтезировать несколькими способами. Первый метод заключается в радикальной циклизации 2-иод-2'-метилтиобифенила под действием ультрафиолетового излучения (ртутная лампа) в течение 45-60 часов[1].
Другой метод основан на использовании тиосалициловой кислоты, которую по тиольной группе алкилируют аллилбромидом, а по карбоксильной группе формируют фениловый эфир. Вакуумный флэш-пиролиз полученного соединения при 650 °С даёт дибензотиофен с выходом 88 %[1].

Также разработан метод получения дибензотиофена, основанный на реакции внутримолекулярного ароматического электрофильного замещения. 2-Бромбифенил подвергают обмену брома на литий и вводят в реакцию с диметилдисульфидом, вводя на место галогена метилтиольную группу. Её затем окисляют до сульфоксида, после чего под действием трифторметансульфокислоты вводят в электрофильную циклизацию с дегидратацией. Деметилирование полученного продукта приводит к дибензотиофену[1].

Также дибензотиофен получали по методу, основанному на анионной циклизации бензинового интермедиата. Для этого на первой стадии 2-фтортиофенол вводят в сочетание по Ульману с 2-хлорнитробензолом в присутствии оксида меди. Затем нитрогруппу восстанавливают железом, а полученную аминогруппу замещают на иод. Обработка трет-бутиллитием приводит к дибензофурану[1].

Наконец, дибензотиофен можно синтезировать из 2,2'-дииодбифенила и источника серы, например сульфида калия либо дисульфида углерода[1].

Строение и физические свойства
В протонном спектре ЯМР (дейтерохлороформ) дибензотиофен даёт набор сигналов ароматических протонов при 7,29–7,33 м. д. (2H), 7,70–7,73 м. д. (1H) и 7,99–8,01 м. д. (1H). В углеродном спектре ЯМР присутствуют сигналы шести типов атомов углерода: 121,7, 122,9, 124,4, 126,8, 135,6, 139,5 м. д.[1]
Химические свойства
Дибензотиофен галогенируется в положения 2 и 8 благодаря донорной активности атома серы. Если же его окислить до сульфона, то группа становится акцепторной, и галогенирование протекает в положения 3 и 7. Наиболее часто дибензотиофен иодируют и бромируют, а полученные галогенпроизводные далее функционализируют[1].
Модификацию положений 4 и 6 проводят при помощи орто-литиирования. Можно получать монолитиевые и дилитиевые производные в зависимости от условий реакции: в сильнощелочной среде и при кипячении в циклогексане литиирование происходит дважды, а при низкой температуре образуется мололитиевое производное. Далее эти соединения вводят в реакцию с теми или иными электрофилами[1].
Примечания
Литература
- Benoit G. Dibenzothiophene (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2014. — doi:10.1002/047084289x.rn01695.
Ссылки
- ЯМР-спектр дибензотиофена. Sigma-Aldrich. Дата обращения: 29 июля 2019.
- КР-спектр дибензотиофена. Sigma-Aldrich. Дата обращения: 29 июля 2019.














