Диоксид хлора
| Диоксид хлора | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Оксид хлора(IV) | ||
| Традиционные названия | Диоксид хлора; двуокись хлора | ||
| Хим. формула | ClO2 | ||
| Рац. формула | |||
| Физические свойства | |||
| Состояние | жидкость или газ | ||
| Молярная масса | 67,45 г/моль | ||
| Плотность | 1,6 ± 0,1 г/см³[2] | ||
| Энергия ионизации | 10,36 ± 0,01 эВ[2][3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −59 °C | ||
| • кипения | 9,7 °C | ||
| Энтальпия | |||
| • образования | +104,60 кДж/моль | ||
| Давление пара | 1 ± 1 атм[2] | ||
| Классификация | |||
| Рег. номер CAS | 10049-04-4 | ||
| PubChem | 24870 | ||
| Рег. номер EINECS | 233-162-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | FO3000000 | ||
| ChEBI | 29415 | ||
| ChemSpider | 23251 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м³ | ||
| ЛД50 | 140-149,2 мг/кг | ||
| Токсичность | Класс опасности 2[1] | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
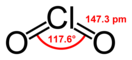
Диокси́д хло́ра (окси́д хлора(IV), двуóкись хлóра) — неорганическое химическое соединение хлора и кислорода, химическая формула . Ядовит.
Физические свойства
При стандартных условиях — газ жёлтого цвета с характерным запахом. При температурах ниже 10 °C сгущается в жидкость красно-коричневого цвета, в твёрдом виде — тёмно-красные кристаллы.
Малоустойчив, может взрываться на свету, при контактах с восстановителями и при нагревании. Теплота испарения диоксида хлора 6,3±0,1 ккал/моль, критическая температура 192 °C, критическое давление 85 атм. Плотность ClO2 уменьшается от 1,973 г/см³ при −60 °C до 1,653 г/см³ при 5 °C. Диоксид хлора хорошо растворим в воде, уксусной и серной кислотах, в четырёххлористом углероде, ацетонитриле, а также в ряде других органических и неорганических растворителей. Растворимость диоксида хлора возрастает с ростом полярности растворителя.
Потенциал ионизации диоксида хлора равен 10,33±0,02 эВ, сродство к электрону 2,378±0,006 эВ. Потенциал окисления-восстановления в водном растворе — = 0,94 В.
Диоксид хлора) имеет нечётное количество электронов (33) и является стабильным радикалом, не проявляющим при нормальных условиях тенденции к димеризации. В газовой фазе спектр ЭПР не наблюдается, что объясняется большим числом вращательных уровней его молекулы. ЭПР-спектр раствора диоксида хлора представляет собой широкий синглет, но при некоторых условиях (например, низких температурах) спектральная линия усложняется, превращаясь в широкий квартет вследствие сверхтонкого расщепления на ядрах хлора 35Cl и 37Cl, для которых константы сверхтонкой структуры равны 1,70±0,03 и 1,37±0,03 мT соответственно.
Получение
Реакция хлора с кислородом в условиях флэш-фотолиза под действием ультрафиолета приводит к образованию диоксида хлора в следовых количествах[4]:
- .
В лаборатории диоксид хлора получают по реакции хлората калия со щавелевой кислотой[5][6]:
- .
Промышленный метод получения основан на реакции восстановления хлората натрия диоксидом серы:
- .
Хранить диоксид хлора в жидком виде сложно ввиду его малой устойчивости и взрывоопасности. В случаях, когда это необходимо, возможно кратковременное хранение в открытом охлаждаемом сосуде. Более устойчивыми являются его растворы в воде и четырёххлористом углероде, сохраняемые при низких температурах. Возможно также довольно долгое хранение в адсорбированном виде: при низкой температуре и с использованием в качестве сорбента силикагеля, который одновременно позволяет освободить диоксид хлора от примесей слабо сорбирующегося на силикагеле в этих условиях элементного хлора, а также воды, прочно удерживаемой силикагелем после высвобождения диоксида хлора при подогревании.
Свойства

Вещество нестабильно — разлагается на хлор и кислород на свету и при нагревании. Является кислотным оксидом. В водных растворах медленно образуются хлористая и хлорноватая кислоты (реакция диспропорционирования):
- .
Разбавленные растворы, устойчивые в темноте, на свету медленно разлагаются.
Образующаяся хлористая кислота очень неустойчива и разлагается:
- .
Диоксид хлора реагирует со многими органическими соединениями выступая как окислитель средней силы. Большинство реакций с участием вещества протекают по механизму одноэлектронного окисления с образованием на первой стадии реакции органических катион-радикалов и хлорит-иона, но возможно протекание и других реакций, в частности, реакции отрыва атома водорода.
Применение
Используется в основном для отбеливания, например, целлюлозы, бумаги, муки и тому подобного, дезинфекции и стерилизации различных материалов. С 2010 года началось применение в США в качестве компонентов зубных паст и ополаскивателей в связи с высокой активностью против бактериальных биоплёнок, создаваемых анаэробными бактериями (CloSYS[7], TheraBreath)[8]. В России аэрозоль диоксида хлора используется для дезинфекции медицинских учреждений[9] и рассматривается в качестве дезинфектанта для транспорта (GreenDez)[10][11].
Физиологическое действие
Диоксид хлора ядовит. Сильный окислитель. Вызывает раздражение слизистых оболочек и кашель. ПДК в воздухе рабочей зоны 1 мг/м3, ЛД50 140—149,2 мг/кг (крысы, перорально).
Вещество относится ко II классу токсичности в соответствии с ГОСТ 12.1.005-76.
В окислительно-восстановительных реакциях молекула хлора способна принять два электрона, а молекула диоксида хлора — пять. В диоксиде хлора электроны принимают атомы кислорода, у хлора — только атомы хлора, и это приводит к заметным различиям в свойствах этих веществ. Реакция между хлором и органическими веществами приводит к присоединению к молекулам последних атомов хлора с образованием токсичных хлорорганических соединений. Диоксид хлора отдаёт органическим веществам в ходе реакции атомы кислорода и по этой причине менее опасен, чем чистый хлор. Именно поэтому диоксид хлора начал активно заменять традиционное хлорирование воды на станциях водоочистки по всему миру (в первую очередь в США). Для обеззараживания того же количества воды нужно меньшее количество диоксида хлора по сравнению с обычным хлором. Кроме того, в такой воде отсутствуют хлорорганические соединения, так как при распаде молекулы диоксида хлора не образуется активный хлор, способный вступать в реакции, поэтому диоксид хлора разрешён для применения в качестве антибактериального агента[12].
Торговые злоупотребления
Продается под названием Miracle Mineral Supplement (MMS) — это токсичный раствор 28 % хлорита натрия вместе с 10 % активатором, раствора лимонной кислоты. Новатором снадобья MMS, которое якобы исцеляет почти от всех болезней, считается оккультист Джим Хамбл, основавший секту Genesis II, Church of Health & Healing (Второе творение: церковь здоровья и исцеления)[13].
Примечания
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76 Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности (с Изменениями N 1, 2)
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0116.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ George Porter, Franklin J. Wright. Studies of free radical reactivity by the methods of flash photolysis. The photochemical reaction between chlorine and oxygen (англ.) // Discussions of the Faraday Society. — 1953. — Vol. 14. — P. 23. — ISSN 0366-9033. — doi:10.1039/df9531400023.
- ↑ Н. Г. Ключников. Руководство по неорганическому синтезу. Изд. второе, переработанное. Москва, изд. «Химия», 1965. Стр. 134.
- ↑ Баудлер М., Брауэр Г., Губер Ф. и др. Руководство по неорганическому синтезу: В 6-ти томах. — М.: Мир, 1985. — Т. 2. — С. 348. — 362 с.
- ↑ Эффективность стабилизированной жидкости для полоскания рта на основе диоксида хлора в снижении неприятного запаха изо рта: 8-недельное рандомизированное контролируемое исследование. CloSYS.ru. Дата обращения: 15 июля 2020. Архивировано 21 октября 2020 года.
- ↑ ProFresh, Therabreath в России. Zona Vita. Дата обращения: 15 июля 2020. Архивировано 3 августа 2020 года.
- ↑ Татьяна Елекоева. Хватит ли Петербургу ресурсов для дезинфекции? «Деловой Петербург» (15 апреля 2020). Дата обращения: 15 июля 2020. Архивировано 15 июля 2020 года.
- ↑ Петербургская компания придумала экспресс-дезинфекторы для «скорой». Regnum (28 мая 2020). Дата обращения: 15 июля 2020. Архивировано 17 июля 2020 года.
- ↑ Российские машины скорой помощи будут дезинфицировать за минуту. РЖД-Партнер. Дата обращения: 15 июля 2020. Архивировано 17 июля 2020 года.
- ↑ CFR - Code of Federal Regulations Title 21. www.accessdata.fda.gov. Дата обращения: 28 октября 2019. Архивировано 13 декабря 2019 года.
- ↑ Олег Меркель. Основные элементы оккультного целительства. На примере Джима Хамбла и его группировки Дженезис II: церковь здоровья & исцеления (2021). Дата обращения: 25 апреля 2021. Архивировано 25 апреля 2021 года.
Литература
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.



![{\displaystyle {\ce {Cl2 + 2 O2 ->[{\ce {UV}}] 2 ClO2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c707d5e6c4755b040bc2aae93af3f9b567284d8)