
Моле́кула — электрически нейтральная частица, образованная из двух или более связанных атомов.
Ква́нтовая хи́мия — направление теоретической химии, рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики. Разделами квантовой химии являются: квантовая теория строения молекул, квантовая теория химических связей и межмолекулярных взаимодействий, квантовая теория химических реакций и реакционной способности и др. Она занимается рассмотрением химических и физических свойств веществ на атомарном уровне. Вследствие того, что сложность изучаемых объектов во многих случаях не позволяет находить явные решения уравнений, описывающих процессы в химических системах, применяют приближенные методы расчета. С квантовой химией неразрывно связана вычислительная химия — дисциплина, использующая математические методы квантовой химии, адаптированные для создания специальных компьютерных программ, используемых для расчета молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, симуляции взаимодействия молекул.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.

Ионная связь — сильная химическая связь между атомами существенно отличающимися между собой по электроотрицательности.
Ван-дер-ваа́льсовы си́лы — силы межмолекулярного взаимодействия с энергией 10—20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. Ван дер Ваальсом в 1869 году.

Ковале́нтная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Рекомбинация — процесс, обратный ионизации. Состоит в захвате ионом свободного электрона. Рекомбинация приводит к уменьшению заряда иона или к превращению иона в нейтральный атом или молекулу. Возможна также рекомбинация электрона и нейтрального атома (молекулы), приводящая к образованию отрицательного иона, и в более редких случаях — рекомбинация отрицательного иона с образованием двух- или трехкратно заряженного отрицательного иона. Вместо электрона в некоторых случаях могут выступать другие элементарные частицы, например мезоны, создавая мезоатомы или мезомолекулы. На ранних этапах развития вселенной происходила реакция рекомбинации водорода — так называемая эпоха первичной рекомбинации.
Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
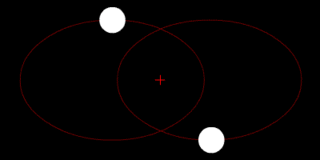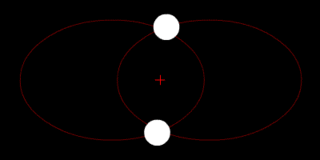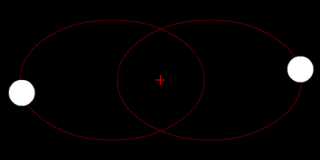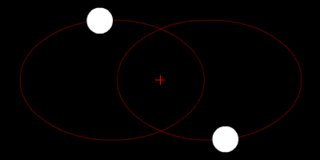
В классической механике, задача двух тел состоит в том, чтобы определить движение двух материальных точек, которые взаимодействуют только друг с другом. Распространённые примеры включают спутник, обращающийся вокруг планеты, планета, обращающаяся вокруг звезды, две звезды, обращающиеся вокруг друг друга, и классический электрон, движущийся вокруг атомного ядра.
А́том водоро́да — физико-химическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра, как правило, входит протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон образует электронную оболочку; наибольшая вероятность обнаружения электрона в единичном объёме наблюдается для центра атома. Интегрирование по сферическому слою показывает, что наибольшая вероятность обнаружения электрона в единичном слое соответствует среднему радиусу, равному боровскому радиусу  ангстрема.
ангстрема.

Комбинационное рассеяние света — неупругое рассеяние оптического излучения на молекулах вещества, сопровождающееся заметным изменением частоты излучения. В отличие от рэлеевского рассеяния, в случае комбинационного рассеяния в спектре рассеянного излучения появляются спектральные линии, которых нет в спектре первичного (возбуждающего) света. Число и расположение появившихся линий определяется молекулярным строением вещества.
Уравнение Власова — система уравнений, описывающих динамику плазмы заряженных частиц с учётом дальнодействующих кулоновских сил посредством самосогласованного поля. Впервые предложена А. А. Власовым в статье и позднее излагается в монографии.

Норма́льные колеба́ния, со́бственные колебания или мо́ды — набор характерных для колебательной системы типов гармонических колебаний. Каждое из нормальных колебаний физической системы, например, колебаний атомов в молекулах, характеризуется своей частотой. Такая частота называется нормальной частотой, или собственной частотой. Набор частот нормальных колебаний составляет колебательный спектр. Произвольное колебание физической системы можно представить в виде суперпозиции различных нормальных колебаний. Вынужденные колебания физической системы испытывают резонанс на частотах, которые совпадают с частотами нормальных колебаний этой системы.
Поляризо́ванность — векторная физическая величина, равная дипольному моменту единицы объёма вещества, возникающему при его поляризации, количественная характеристика диэлектрической поляризации.

Межа́томное взаимоде́йствие — электромагнитное взаимодействие электронов и ядра одного атома с электронами и ядром другого атома. Межатомное взаимодействие зависит от расстояния между атомами и электронных оболочек атомов. Мерой межатомного взаимодействия является энергия взаимодействия атомов. Энергия взаимодействия атомов лежит в широком диапазоне. Энергия межатомного взаимодействия является отчётливо выраженной периодической функцией положительного заряда ядра атома.

Фриц Вольфганг Лондон — немецкий физик-теоретик. Его фундаментальные труды по теории химической связи и межмолекулярных сил считаются сегодня классическими и рассматриваются в современных учебниках по физической химии.
Фо́рмула Ло́ренца — Ло́ренца связывает показатель преломления вещества с электронной поляризуемостью частиц, из которых оно состоит. Формулу получили датский физик Людвиг В. Лоренц и голландский физик Хендрик А. Лоренц в 1880 году независимо друг от друга.
Фо́рмула Кла́узиуса — Моссо́тти описывает связь статической диэлектрической проницаемости диэлектрика с поляризуемостью составляющих его частиц. Получена независимо друг от друга в 1850 г. Оттавиано Ф. Моссотти и в 1879 г. Рудольфом Ю. Э. Клаузиусом. В случаях, когда вещество состоит из частиц одного сорта, в Гауссовой системе единиц формула имеет вид:

Уравнение Брейта — релятивистское волновое уравнение, полученное Грегори Брейтом в 1929 году на основе уравнения Дирака. Оно описывает две или более массивные частицы со спином 1/2, которые взаимодействуют электромагнитно с точностью до первого порядка теории возмущений. Оно учитывает магнитные взаимодействия и запаздывающие эффекты с точностью до 1/c². Когда другие квантовые электродинамические эффекты незначительны, это уравнение показывает хорошее согласование с экспериментом. Впервые оно было получено из дарвиновского лагранжиана, а позже доказано в теории поглощения Уилера — Фейнмана и, наконец, в квантовой электродинамике.















