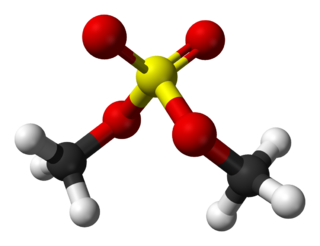
Дихлорамин-Т
| Дихлорамин-Т | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | N,N-дихлор-4-толуолсульфамид |
| Традиционные названия | Дихлорамин-Т |
| Хим. формула | CH3C6H4SO2NCl2 |
| Рац. формула | C7H7Cl2NO2S |
| Физические свойства | |
| Состояние | бесцветные/жёлтые кристаллы |
| Молярная масса | 240,11 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 83 °C |
| Химические свойства | |
| Растворимость | |
| • в хлороформе | 40% |
| Классификация | |
| Рег. номер CAS | 473-34-7 |
| PubChem | 68056 |
| Рег. номер EINECS | 207-462-4 |
| SMILES | |
| InChI | |
| ChemSpider | 61371 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дихлорамин-Т (N,N-дихлор-4-толуолсульфамид, п-толуолдихлорсульфамид) — органическое соединение, дихлорамид п-толуолсульфокислоты. Кристаллическое вещество жёлтовато-белого цвета, нерастворимое в воде.
Получение
Основным лабораторным способом получения является хлорирование щелочного раствора п-толуолсульфамида с помощью хлора. К раствору щёлочи, приготовленного растворением 18 г гидроксида натрия в 180 мл воды, добавляют 8,7 г п-толуолсульфамида, при этом постоянно перемешивая. Раствор фильтруют, после чего через фильтрат пропускают газообразный хлор, делая это до тех пор, пока проба фильтрата не будет выделять осадок дихлорамина-Т. Температура на данном этапе составляет 15—20 °C. Выделившийся продукт отфильтровывают, промывают холодной водой, чтобы избавиться от ионов хлора, и сушат при температуре, не превышающей 40 °C. При соблюдении данной методики выход достигает 95%. При этом протекает следующая реакция[1]:
Промышленным способом получения является хлорирование водного раствора п-толуолсульфамида кальция. Процесс включает 4 стадии:
- Приготовление раствора п-толуолсульфамида кальция.
- Хлорирование раствора с помощью газообразного хлора при температуре 15—20 °C.
- Фильтрование дихлорамина-Т.
- Сушка продукта на эмалированных противнях при температуре, не превышающей 40 °C.
В среднем при данном способе на 1 т дихлорамина-Т уходит 710 кг п-толуолсульфамида, 300 кг гидроксида кальция и 600 кг хлора. При этом основными примесями в продукте являются п- и о-толуолсульфамиды[1].
Существует ещё несколько способов получения дихлорамина-Т:
- Хлорирование водного раствора монохлорамина-Т с помощью хлора:
- Хлорирование водной суспензии п-толуолсульфамида с помощью хлора[1]:
Физические свойства
Дихлорамин-Т представляет собой кристаллическое вещество белого цвета. В воде и уксусной кислоте малорастворим[2], хорошо растворяется в органических растворителях, к примеру растворимость в хлороформе при 20 °C составляет 40%[1]. Температура плавления равна 83 °C, выше неё разлагается с самовоспламенением[3].
Химические свойства
- Является хлорирующим агентом. К примеру, при нагревании с водным раствором гидроксида натрия переходит в монохлорамин-Т:
- Легко гидролизуется водой, образуя п-толуолсульфамид. Процесс протекает быстрее при нагревании:
- Соляной кислотой при нагревании разлагается с выделением хлора[1]:
Применение
Используется в качестве дегазирующего агента в виде, например, 1,5%-ного раствора в бензине[4].
Является исходным веществом для получения парактивина — отбеливающего средства, применяемого в текстильной промышленности и получаемого при смешении 55 частей дихлорамина-Т и 45 частей сульфата алюминия в виде кристаллов[1].
Применяется в виде растворов в органических растворителях[5].
Применяется в качестве антисептического и дезинфекционного средства в виде 1—2%-ного раствора в хлорированном парафине для обработки слизистых оболочек и 5%-ного раствора для перевязок ран. По сравнению с неорганическими гипохлоритами, которые применяются для подобных целей, более удобен для применения и вызывает меньшее раздражение[6].
В лабораторной практике используется для галогенирования и галогеналкоксилирования[7].
Применяется в качестве хемосорбента, к примеру, им пропитывают защитную одежду[8].
Безопасность
Раздражает кожу и дыхательные пути[1].
Легко разлагается при нагревании выше температуры плавления. Данный процесс сопровождается самовоспламенением. Если нагревать быстро, происходит вспышка[1]. В связи с этим известны случаи взрывов в промышленной аппаратуре, применяемой для производства дихлораминов, вызванные термическим разложением осадка и воспламенением при контакте с кислородом, содержащимся в воздухе[9].
Примечания
- ↑ 1 2 3 4 5 6 7 8 Ошин, 1978, с. 469-472.
- ↑ Никольский и др., 1971, с. 662-663.
- ↑ Кнунянц и др., 1998, с. 283.
- ↑ Боровая, 1968, с. 275.
- ↑ Лебедев, 1975, с. 144.
- ↑ Дженкинс и др., 1949, с. 458.
- ↑ Петров и др., 1965, с. 368.
- ↑ Гончаров и др., 1978, с. 100.
- ↑ Бесчастнов и др., 1976, с. 294.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Промышленные хлорорганические продукты / под ред. Л. А. Ошина. — М.: Химия, 1978. — 656 с.
- Гончаров А.И., Корнилов М.Ю. Справочник по химии. — 2-е, испр.. — К.: Вища школа, 1978. — 308 с.
- Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. — 3-е, перераб.. — М.: Химия, 1975. — 608 с.
- Бесчастнов М.В., Соколов В.М., Кац М.И. Аварии в химических производствах и меры их предупреждения. — М.: Химия, 1976. — 368 с.
- Боровая М.С. Лаборант нефтяной и газовой лаборатории. — М.: Недра, 1968. — 309 с.
- Г. Дженкинс, У. Хартунг. Химия органических лекарственных препаратов. — М.: Государственное издательство иностранной литературы, 1949. — 309 с.
- Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. — М.: Высшая школа, 1965.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.