Термодина́мика — раздел физики, изучающий наиболее общие свойства макроскопических систем и способы передачи и превращения энергии в таких системах.

Теплопрово́дность — способность материальных тел проводить тепловую энергию от более нагретых частей тела к менее нагретым частям тела путём хаотического движения частиц тела. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества.
Идеа́льный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах. В этой модели, во-первых, предполагается, что составляющие газ частицы не взаимодействуют друг с другом, то есть их размеры пренебрежимо малы, поэтому в объёме, занятом идеальным газом, нет взаимных неупругих столкновений частиц. Частицы идеального газа претерпевают столкновения только со стенками сосуда. Второе предположение: между частицами газа нет дальнодействующего взаимодействия, например, электростатического или гравитационного. Дополнительное условие упругих столкновений между молекулами и стенками сосуда в рамках молекулярно-кинетической теории приводит к термодинамике идеального газа.
Уде́льная теплоёмкость — это отношение теплоёмкости к массе, теплоёмкость единичной массы вещества ; физическая величина, численно равная количеству теплоты, которое необходимо передать единичной массе данного вещества для того, чтобы его температура изменилась на единицу.
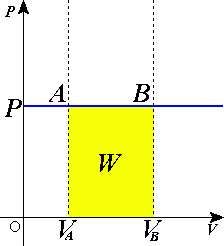
Изопроце́ссы — термодинамические процессы, во время которых количество вещества и один из параметров состояния: давление, объём, температура или энтропия — остаётся неизменным. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный. Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара, изохора, изотерма и адиабата соответственно. Изопроцессы являются частными случаями политропного процесса.
Политро́пный процесс, политропи́ческий процесс — термодинамический процесс, во время которого теплоёмкость газа остаётся неизменной.
Адиабати́ческий, или адиаба́тный проце́сс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством. Серьёзное исследование адиабатических процессов началось в XVIII веке. В целом термин «адиабатический» в разных областях науки всегда подразумевает сохранение неизменным какого-то параметра. Так в квантовой химии, электронно-адиабатический процесс — это процесс, в котором не изменяется квантовое число электронного состояния. Например, молекула всегда остаётся в первом возбуждённом состоянии вне зависимости от изменения положения атомных ядер. Соответственно неадиабатическим называется процесс, в котором происходит изменение какого-то важного параметра.
Уравне́ние состоя́ния идеа́льного га́за — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
 ,
,
Универса́льная га́зовая постоя́нная — константа, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К. Равна произведению постоянной Больцмана на число Авогадро. Обозначается латинской буквой R.

Молекулярно-кинетическая теория — теория, возникшая в XIX веке и рассматривающая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
- все тела состоят из частиц: атомов, молекул и ионов;
- частицы находятся в непрерывном хаотическом движении (тепловом);
- частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Соотношение Майера — это уравнение, связывающее теплоёмкость идеального газа при постоянном давлении с его теплоёмкостью при постоянном объёме. Для газа, взятого в количестве одного моля, соотношение Майера имеет вид:

Уравне́ние Ван-дер-Ва́альса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Моля́рная теплоёмкость — отношение теплоёмкости к количеству вещества, теплоёмкость одного моля вещества.

Теорема о равнораспределении кинетической энергии по степеням свободы, закон равнораспределения, теорема о равнораспределении — связывает температуру системы с её средней энергией в классической статистической механике. В первоначальном виде теорема утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами, например, средняя кинетическая энергия поступательного движения молекулы должна равняться средней кинетической энергии её вращательного движения.
Изохо́рный, или изохори́ческий проце́сс — термодинамический изопроцесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать или охлаждать вещество в сосуде неизменного объёма.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Сжимаемость — свойство вещества изменять свой объём под действием всестороннего равномерного внешнего давления. Сжимаемость характеризуется коэффициентом сжимаемости, который определяется формулой