
Соля́ная кислота́ — сильная неорганическая кислота. Раствор хлороводорода в воде.
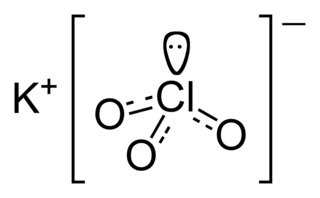
Хлорат калия — калиевая соль хлорноватой кислоты.
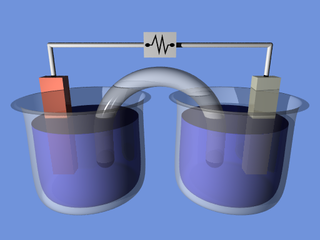
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.

Гравиметрический анализ — метод количественного химического анализа, основанный на точном измерении массы вещества. Использует закон сохранения массы веществ при химических превращениях. Сыграл большую роль в становлении закона постоянства состава химических соединений, закона кратных отношений, периодического закона и др. Применяется для определения химического состава различных объектов, качества сырья и готовой продукции, содержания кристаллизационной воды в солях, зольности топлива и так далее.

Галоге́ны — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева.

Хлори́д ка́лия — химическая неорганическая средняя калиевая соль соляной кислоты.

Хлора́ты — группа химических соединений, соли хлорноватой кислоты HClO3 или один из видов оксосолей хлора. Хлорат анион имеет структуру тригональной пирамиды (dCl—О = 0,1452—0,1507 нм, угол OClO = 106°). Анион ClO3− не образует ковалентных связей через атом О и не склонен образовывать координационные связи.
Акти́вность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью, на которую подаётся газообразный водород с давлением в 1 атм. и погружённую в водный раствор, содержащий ионы водорода с активностью равной 1. Потенциал стандартного водородного электрода при стандартных условиях принят равным 0.

Ка́ломель (от др.-греч. καλός — красивый и μέλας — чёрный) Hg2Cl2 — редкий минерал из класса галогенидов, хлорид ртути(I).
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.

Хлори́д рту́ти(II), сулема́ (от позднелат. sublimatum — буквально — высоко поднятое, вознесённое, то есть добытое возгонкой) — бинарное неорганическое соединение состава HgCl2, представляющее бесцветные кристаллы ромбической системы. Является сильнодействующим ядовитым веществом.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Было выведено немецким физико-химиком Вальтером Нернстом.
Хлоридсере́бряный электро́д (ХСЭ) благодаря стабильности потенциала и простоте конструкции является одним из наиболее часто употребляемых в лабораторной практике электродов сравнения.

Хлори́ды — химические соединения хлора с менее электроотрицательными элементами, в которых он проявляет степень окисления –1.

Хлори́д рту́ти(I), также ка́ломель, дихлорид диртути, хлори́д дирту́ти(2+) — неорганическое вещество с формулой  , соединение ртути и хлора. Относится к классу бинарных соединений, может рассматриваться как димер соли одновалентной ртути и соляной кислоты. Кристаллическое вещество белого цвета.
, соединение ртути и хлора. Относится к классу бинарных соединений, может рассматриваться как димер соли одновалентной ртути и соляной кислоты. Кристаллическое вещество белого цвета.

Димер хлорида золота(III) — неорганическое соединение, соль металла золота и хлористоводородной кислоты, с формулой Au2Cl6. При нормальных условиях представляет собой блестящие призматические рубиново-красные кристаллы, хорошо растворимые в воде и органических растворителях. Легко восстанавливается до элементарного золота.
Окси́д зо́лота(I) — бинарное неорганическое соединение металла золота и кислорода с формулой  . При стандартных условиях представляет собой неустойчивый фиолетовый порошок или синий гидрозоль.
. При стандартных условиях представляет собой неустойчивый фиолетовый порошок или синий гидрозоль.
Хингидроновый электро́д используется для измерения рН в интервале от 0 до 6; в буферных растворах в отсутствие сильных окислителей в интервале от 0 до 8,5. Схематически записывается как: Pt(тв.)гладкая|хингидрон насыщенный, исследуемый расствор Электродная реакция:
С6Н4(ОН)2 → С6Н4О2 + 2Н+ + 2е

Экзергонические реакции, также самопроизвольные реакции — согласно второму началу термодинамики это химические реакции, которые протекают без притока энергии извне. Величина свободной энергии таких реакций всегда отрицательна, т.е. ΔG° < 0. Большинство химических реакций, которые протекают в окружающей среде — экзергонические, вследствие этого они являются термодинамически выгодными, в отличие от эндергонических. Примером экзергонических реакций являются процессы электролитической диссоциации, окисления и горения, сорбционные процессы, фотохимические процессы (фотодиссоциация), в живых организмах это процессы катаболизма — гликолиз, липолиз, протеолиз, окисление жирных кислот и многие другие.

























