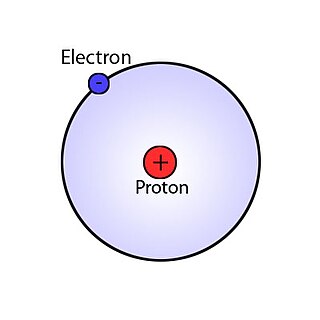
А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его химических свойств.

Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.

А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса. Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что более чем в 10 тысяч раз меньше размеров самого атома. Атомные ядра изучает ядерная физика.

Прото́н — одна из трёх элементарных частиц, из которых построено обычное вещество. Протоны входят в состав атомных ядер; порядковый номер химического элемента в таблице Менделеева равен количеству протонов в его ядре.
А́томная едини́ца ма́ссы, она же дальто́н, она же углеродная единица — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы определяется как 1⁄12 массы свободного покоящегося атома углерода 12C, находящегося в основном состоянии.
А́томная ма́сса — масса атома. Единица измерения в СИ — килограмм, обычно применяется внесистемная единица — атомная единица массы.
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева.

Заря́довое число́ атомного ядра — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядра химического элемента в таблице Менделеева. Обычно обозначается буквой Z.

Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или более элементов. Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью . Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
Хими́ческая фо́рмула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков. Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура веществ. Одним из первых начал использовать их русский химик А. А. Иовский.

Йоха́ннес Ро́берт Ри́дберг — шведский физик. Наиболее известен открытием в 1888 году формулы Ридберга, которая описывает длины волн спектральных линий излучения атомов водорода.
Гипотеза Праута — предположение о том, что водород является первичной материей, из которой путём своего рода конденсации образовались атомы всех других элементов.

Пра́ут, Уи́льям — английский химик, врач и религиозный философ. Член Лондонского королевского общества. Известен как:
- автор гипотез Праута о том, что все атомы химических элементов могут получаться путём конденсации атомов водорода и что все веса атомов должны быть кратны весу атома водорода;
- первооткрыватель соляной кислоты, как важнейшего компонента желудочного сока, и её роли в процессе пищеварения.

Бо́ровская моде́ль а́тома — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Эрнестом Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка:  .
.

Антониус Йоханнес ван ден Брук — нидерландский юрист и физик-любитель. Несмотря на отсутствие специального образования, получил несколько результатов, оставивших след в истории науки. Ему принадлежит первая формулировка положения о равенстве порядкового номера элемента в периодической системе заряду атомного ядра. С именем ван ден Брука связано возникновение ранних теоретических представлений о составе ядра, в частности им была предложена протон-электронная модель ядерного строения. В своих работах он неоднократно пытался найти верный принцип расположения элементов в периодической системе и разработать метод вычисления всех возможных в природе изотопов.

Лу́ис Карл Ге́нрих Фри́дрих Па́шен — немецкий физик-экспериментатор. Член Берлинской академии наук (1925), иностранный почётный член Академии наук СССР (1930).

Жан Серве Стас — известный бельгийский химик. Он провёл первые точные измерения атомных масс.

Атомная теория — научная теория, согласно которой материя состоит из частиц, называемых атомами. Теория атома берёт своё начало в древней философской традиции, известной как атомизм. Согласно этой идее, если взять кусок материи и разрезать его на все более мелкие части, он в конечном итоге достигнет точки, когда части нельзя будет разрезать на что-либо меньшее. Древнегреческие философы называли эти гипотетические конечные частицы материи атомосом, что означало «неразрезаемый».

Артур Эрих Гааз — австрийский физик-теоретик и популяризатор науки, автор работ, посвящённых квантовой теории, атомной физике, теоретической спектроскопии, истории физики. Гаазу принадлежит первая модель атома, в которую было непосредственно введено представление о квантах энергии и которая может рассматриваться как предшественник боровской модели атома.