Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Характерными примерами таких электроотрицательных атомов являются атомы элементов второго периода периодической системы — азота, кислорода и фтора, а также атомы некоторых других элементов с высокой относительно водорода электроотрицательностью. Водородные связи могут быть межмолекулярными или внутримолекулярными.

Жиры́, также триглицери́ды, триацилглицериды — органические вещества, продукты этерификации карбоновых кислот и трёхатомного спирта глицерина.
Глико́лиз, или путь Эмбдена — Мейергофа — Парнаса — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх путей окисления глюкозы, встречающихся в живых клетках. Реакция гликолиза в суммарном виде выглядит следующим образом:
- Глюкоза + 2НАД+ + 2АДФ + 2Pi → 2 пируват + 2НАД*H + 2Н+ + 2АТФ + 2Н2O.

Аденозинтрифосфа́т (ион), Аденозинтрифосфорная кислота, АТФ — нуклеозидтрифосфат, играющий основную роль в обмене энергии в клетках живых организмов. Это универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Глюконеогене́з — метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений. Наряду с гликогенолизом, этот путь поддерживает в крови уровень глюкозы, необходимый для работы многих тканей и органов, в первую очередь, нервной ткани и эритроцитов. Он служит важным источником глюкозы в условиях недостаточного количества гликогена, например, после длительного голодания или тяжёлой физической работы. Глюконеогенез является обязательной частью цикла Кори, кроме того, этот процесс может быть использован для превращения пирувата, образованного при дезаминировании аминокислот аланина и серина.

Ци́кл трикарбо́новых кисло́т (сокр. ЦТК, цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные остатки (СН3СО-) окисляются до диоксида углерода (CO2). При этом за один цикл образуется 2 молекулы CO2, 3 НАДН, 1 ФАДH2 и 1 ГТФ (или АТФ). Электроны, находящиеся на НАДН и ФАДH2, в дальнейшем переносятся на дыхательную цепь, где в ходе реакций окислительного фосфорилирования образуется АТФ.
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп COOH. Кислотные свойства объясняются тем, что данная группа может сравнительно легко отщеплять протоны. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа диссоциации равна 1,75⋅10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые кислоты.

Ангидриды карбоновых кислот — соединения общей формулы R1CO−O−COR2, в которых две ацильных группы присоединены к одному и тому же атому кислорода. В зависимости от природы ацильных групп ангидриды могут быть «простыми» (R1 = R2, например, уксусный ангидрид (CH3CO)2O, смешанными (различные ацильные остатки) или циклическими (R1 и R2 являются частями одной молекулы).

Хлорангидри́д карбо́новой кислоты́ (ацилхлорид) — производное карбоновой кислоты, в которой гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора. Общая формула R-COCl. Первый представитель с R=H не существует, хотя смесь CO и HCl в реакции Гаттермана — Коха ведёт себя подобно хлорангидриду муравьиной кислоты.

Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота весьма токсична (в больших концентрациях). Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, многие из них - токсичны, канцерогенны.
Двухосновные карбоновые кислоты — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал.

Клеточное, или тканевое дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов, в ходе которых происходит окисление углеводов, липидов и аминокислот до углекислого газа и воды, а также образование энергии. Высвобожденная энергия запасается в химических связях макроэргических соединений и может быть использована по мере необходимости. Входит в группу процессов катаболизма. О физиологических процессах транспортировки к клеткам многоклеточных организмов кислорода и удалению от них углекислого газа см. статью Дыхание.
Себаци́новая кислота (декандиовая кислота) НООС(СН2)8СООН — двухосновная предельная карбоновая кислота (лат. sebaceus — свечное масло, сало). Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры себациновой кислоты называются себацинатами.

Пентаоксид фосфора, также оксид фосфора(V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулами P4O10 и P2O5. Бесцветный кристаллический порошок, реагирует с водой; ядовит.

Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид. Высший оксид хлора, в котором он проявляет степень окисления +7.

Диэтиленгликоль, двуэтиленовый спирт (дигликоль), ДЭГ — химическое соединение, представитель двухатомных спиртов.
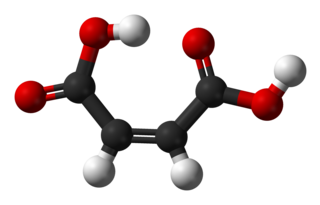
Малеи́новая кислота́ (хим. формула — HOOC-CH=CH-COOH или H4C4O4) — двухосновная непредельная органическая кислота.
Макроэргические связи — это ковалентные связи, которые гидролизуются с выделением значительного количества энергии: 40 кДж/моль и более.
Ацетогенез — биохимический процесс, в результате которого из диоксида углерода и донора электронов образуется уксусная кислота (ацетат). Данный процесс используют анаэробные организмы в последовательности биохимических реакций восстановительного ацетил-КoA пути. Группа различных видов бактерий, способных к ацетогенезу, называется ацетогенами. Некоторые ацетогены способны синтезировать ацетат автотрофно из диоксида углерода и водорода. Суммарная реакция автотрофного синтеза ацетата:
 ΔG°'= -95 кДж/моль
ΔG°'= -95 кДж/моль