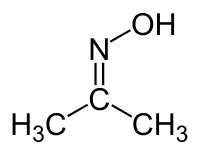
Оксим ацетона
| Оксим ацетона[1][2] | |
|---|---|
 | |
| Общие | |
| Традиционные названия | ацетоноксим |
| Хим. формула | C3H7NO |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 73,09 г/моль |
| Плотность | 0,901 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 60–63 °C |
| • кипения | 135 °C |
| Классификация | |
| Рег. номер CAS | 127-06-0 |
| PubChem | 67180 |
| Рег. номер EINECS | 204-820-1 |
| SMILES | |
| InChI | |
| RTECS | AL6825000 |
| ChEBI | 15349 |
| ChemSpider | 60524 |
| Безопасность | |
| Краткие характер. опасности (H) | H228, H312, H317, H318, H351 |
| Меры предостор. (P) | P210, P280, P305+P351+P338+P310, P370+P378 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксим ацетона (ацетоноксим) — органическое вещество, производное ацетона и гидроксиламина.
Получение
Препаративный метод получения заключается в конденсации ацетона и гидроксиламина. Очистка проводится перекристаллизацией из петролейного эфира или гексана либо сублимацией[1].
Строение и физические свойства
Оксим ацетона растворим в основных органических растворителях[1].
Химические свойства
Образование эфиров
При обработке основанием (например, гидридом натрия, карбонатом калия или гидроксидом натрия) и затем алкилгалогенидом оксим ацетона хорошо образует простые эфиры. Анион оксима ацетона также присоединяется к акрилатам по реакции Михаэля[1].
Оксим ацетона также можно ацилировать ацилгалогенидами с образованием соответствующих сложных эфиров. Те же сложные эфиры можно получить напрямую из оксима ацетона и карбоновой кислоты в присутствии карбодиимидных конденсирующих реагентов (EDC, ДЦК). Описаны также ферментативные процессы получения сложных эфиров оксима ацетона[1].
Алкилирование по метильной группе
При обработке двумя эквивалентами сильного основания, например бутиллитием, оксим ацетона превращается в дианион, который при взаимодействии с алкилгалогенидами и эпоксидами алкилируется по атому углерода. После первого алкилирования продукт можно ещё раз обработать основанием и провести алкилирование вторым электрофилом по тому же атому[1].

Циклизации и циклоприсоединения
Оксим ацетона применяется для синтеза изоксазолов. Для этого дианион этого соединения вводят в реакцию с амидами, сложными эфирами, α,β-непредельными и активированными кетонами, что даёт β-гидрокси- и β-кетооксимы, которые можно в кислой среде циклизовать в изоксазолы[1].

Также оксим ацетона вступает в реакцию с электронодефицитными алкенами в реакцию Михаэля и последующую реакцию 1,3-диполярного циклоприсоединения. На первой стадии алкен алкилирует оксим по атому азота, образуя соответствующий нитрон, который далее реагирует со вторым эквивалентом алкена, давая изоксазолидин[1].

Примечания
- ↑ 1 2 3 4 5 6 7 8 EROS, 2007.
- ↑ Acetone oxime 98%. Sigma-Aldrich. Дата обращения: 1 августа 2019. Архивировано 13 ноября 2015 года.
Литература
- Weinreb S. M., Borstnik K. Acetone Oxime (англ.) // Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2007. — doi:10.1002/047084289X.rn00765.
Ссылки
- ЯМР-спектр оксима ацетона. Sigma-Aldrich. Дата обращения: 29 июля 2019. Архивировано 1 августа 2019 года.
- КР-спектр оксима ацетона. Sigma-Aldrich. Дата обращения: 29 июля 2019. Архивировано 1 августа 2019 года.

![{\displaystyle {\mathsf {Me_{2}C\!\!=\!\!NOH{\xrightarrow[{}]{\text{1. NaH; 2. RX}}}Me_{2}C\!\!=\!\!NOR}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cc18543afd1ffbe11e40f0936fa214ad37f4c76)