Оцениваемая величина
Оцениваемая величина (жарг. эстиманд, от англ. Estimand) — это величина, которая должна быть оценена в ходе статистического анализа [1]. Этот термин используется для того, чтобы отличать цель статистического вывода от метода получения апроксимации этой цели, то есть оценочной функции (способа оценивания, оператора оценки), и конкретного значения, полученного с помощью данного метода и набора данных, то есть оценки [2]. Например, нормально распределенная случайная величина Х определяется двумя параметрами: средним значением μ и дисперсией σ2. Оценочная функция дисперсии:
s2 = для набора данных дает оценку 7, тогда s2 является оценочной функцией (способом оценивания) , а является оцениваемой величиной.
Определение
Оцениваемая величина — это точное описание эффекта вмешательства, отражающее клинический вопрос, являющийся целью исследования. Оцениваемая величина обобщает на популяционном уровне, какими были бы исходы у одних и тех же пациентов при различных сравниваемых условиях вмешательства [3].
По отношению к оценочной функции оцениваемая величина представляет собой исход применения различных терапевтических вмешательств интереса. Формально его можно рассматривать как любую величину, которая должна быть оценена в эксперименте любого типа [4].
Обзор
Оцениваемая величина тесно связана с мишенью или целью анализа и описывает то, что должно быть оценено на основе интересующего вопроса [5]. Этим оцениваемая величина отличается от оценочной функции, определяющей конкретное правило (метод), в соответствии с которым должна быть оценена оцениваемая величина. Оцениваемая величина зачастую не содержит конкретных предположений, например относительно недостающих данных, однако эти предположения должны быть сформулированы при определении конкретной оценочной функции. Поэтому логично проводить анализы чувствительности с использованием различных оценочных функций для одной и той же оцениваемой величины для проверки устойчивости статистического вывода к различным допущениям [6].
По мнению исследователей Ian Lundberg, Rebecca Johnson и Brandon M. Stewart, в количественных исследованиях зачастую не определена конкретная оцениваемая величина, и в таком случае читателю трудно оценить, являются ли подходящими использованные статистические процедуры в исследовании [1].
Примеры
Если интересующий вопрос заключается в том, приводит ли внедрение вмешательства такого, как кампания по вакцинации, в определённой популяции в стране к снижению числа смертей в этой популяции в этой стране, то нашей оцениваемой величиной будет определённая мера снижения риска (например, это может быть отношение монетных рисков или отношение рисков за год). Для получения оценки этой оцениваемой величины у нас могут быть данные клинического исследования. Оценивая эффект на популяционном уровне необходимо отразить, что некоторые люди могут отказаться от вакцинации, поэтому исключение из анализа тех, кто отказался от вакцинации в рамках клинического исследования, может быть нецелесообразным. Более того, мы можем не знать о статусе выживания всех тех, кто был вакцинирован, и в отношении этих субъектов необходимо будет сформулировать предположения для определения оценочной функции.
Одной из возможных оценочных функций для получения конкретной оценки может быть отношение моментных рисков на основе анализа выживаемости, полагая конкретное распределение выживаемости, проведенного на данных от всех субъектов, которым было предложено вмешательствах, и рассматривая выбывания из-под наблюдения как цензурирование справа в рамках случайного цензурирования. Может оказаться, что популяция в исследовании отличается от популяции, в которой будет проводиться кампания по вакцинации, в таком случае это также необходимо учитывать. Альтернативная оценочная функция для анализа чувствительности может предполагать, что вероятность смерти субъекта, витальный статус которых не был отслежен до конца исследования, может быть выше на определённую величину.
Эпидемиологический подход
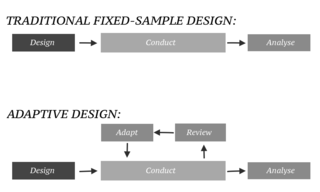
При проведении клинических исследований практикующие врачи часто хотят сосредоточиться на оценке эффектов вмешательства в популяции субъектов. Вышеупомянутые клинические условия выстроены с учётом идеальных сценариев, далеких от сопутствующих, или интеркуррентных, явлений. Однако в реальности необходимо учитывать вариабельность при планировании и проведении исследований [7]. Построение фундаментальных целей с учётом конструкции оцениваемых величин в клинической медицине позволяет врачам согласовать цель клинического исследования с дизайном исследования, конечной точкой и анализом для улучшения планирования исследования и интерпретации результатов анализа [8]. Это подразумевает, что оцениваемая величина позволяет явно указать, каким образом сопутствующие явления будут учитываться в достижении цели исследуемого вмешательства.
ICH
Международный совет по гармонизации технических требований к лекарствам для медицинского применения (ICH) 22 октября 2014 года выпустил окончательный документ-концепцию «Выбор соответствующих оцениваемых величин и определение анализов чувствительности в клинических исследованиях» в качестве дополнения к руководству E9 [9]. О публикации проекта этого дополнения по определению соответствующих оцениваемых величин для клинического исследования/ анализов чувствительности для обсуждения было объявлено ICH 16 октября 2017 года [10][11]. Финальное дополнение к руководству ICH E9 было опубликовано 20 ноября 2019 года [3].
Предлагая структурированную основу для перевода целей клинического исследования в соответствующий дизайн исследования, его проведение и анализ, ICH стремится к улучшению обсуждения между фармацевтическими компаниями и регулирующими органами по программам разработки лекарств. Конечная цель состоит в том, чтобы убедиться, что клинические исследования предоставляют четко определённую информацию об эффектах изучаемых лекарств.
Примечания
- ↑ 1 2 Ian Lundberg, Rebecca Johnson, Brandon M. Stewart. What Is Your Estimand? Defining the Target Quantity Connects Statistical Evidence to Theory (англ.) // American Sociological Review. — 2021-06. — Vol. 86, iss. 3. — P. 532–565. — ISSN 0003-1224. — doi:10.1177/00031224211004187. Архивировано 28 февраля 2023 года.
- ↑ L. V. Jones. The Collected Works of John W. Tukey: Philosophy and Principles of Data Analysis 1965-1986. — CRC Press, 1987-05-15. — 630 с. — ISBN 978-0-534-05101-3. Архивировано 1 апреля 2024 года.
- ↑ 1 2 International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (2019). ADDENDUM ON ESTIMANDS AND SENSITIVITY ANALYSIS IN CLINICAL TRIALS. Дата обращения: 11 апреля 2024. Архивировано 31 марта 2024 года.
- ↑ Rachael Lawrance, Evgeny Degtyarev, Philip Griffiths, Peter Trask, Helen Lau, Denise D’Alessio, Ingolf Griebsch, Gudrun Wallenstein, Kim Cocks, Kaspar Rufibach. What is an estimand & how does it relate to quantifying the effect of treatment on patient-reported quality of life outcomes in clinical trials? // Journal of Patient-Reported Outcomes. — 2020-08-24. — Т. 4, вып. 1. — С. 68. — ISSN 2509-8020. — doi:10.1186/s41687-020-00218-5.
- ↑ [National Research Council (2010). The Prevention and Treatment of Missing Data in Clinical Trials. Panel on Handling Missing Data in Clinical Trials. Committee on National Statistics, Division of Behavioral and Social Sciences and Education. Washington, DC: The National Academies Press. The Prevention and Treatment of Missing Data in Clinical Trials].
- ↑ International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (2014). Draft (final) concept paper on choosing appropriate estimands and definining sensitivity analyses in confirmatory clinical trials
- ↑ Estimands – What you need to know (амер. англ.). www.quanticate.com. Дата обращения: 11 апреля 2024. Архивировано 25 сентября 2023 года.
- ↑ «Estimand Framework: What is it and Why You Need it in Your Clinical Trial». ERT. 4 March 2020.
- ↑ «Choosing Appropriate Estimands and Defining Sensitivity Analyses in Clinical Trials» (PDF). Oct 23, 2015.
- ↑ «ICH releases finalised, draft Guidelines and publishes working party membership for first time». Oct 16, 2017.
- ↑ «Estimands and Sensitivity Analysis in Clinical Trials E9(R1) Current Step 2 version» (PDF). Jun 16, 2017