
Физи́ческая хи́мия — раздел химии, наука об общих законах строения, структуры и превращения химических веществ. Исследует химические явления с помощью теоретических и экспериментальных методов физики. Наиболее обширный раздел химии.
Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается.
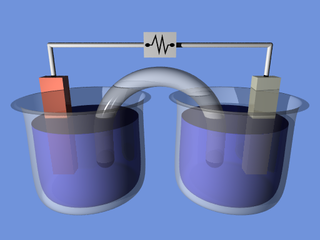
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.

Ано́д — электрод электронного или электротехнического прибора или устройства, характеризующийся тем, что движение электронов во внешние цепи направлено от него.

Корро́зия — самопроизвольное разрушение металлов и сплавов в результате химического, электрохимического или физико-химического взаимодействия с окружающей средой. Разрушение по физическим причинам не является коррозией, а характеризуется понятиями «эрозия», «истирание», «износ». Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде.
Окисли́тель — вещество, в состав которого входят атомы, присоединяющие к себе во время химической реакции электроны. Иными словами, окислитель — это акцептор электронов.

Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.

Электрометаллургия — совокупность методов получения металлов, основанных на электролизе (электрохимия) или на нагреве электрическим током (электротермия). Эти методы применяют главным образом для получения очень активных металлов — щелочных, щёлочноземельных и алюминия, а также производства легированных сталей.
Электрохимический ряд активности металлов (ряд напряжений, ряд (вытеснения) Бекетова, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов E0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me

Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода являются: Pt/Fe3+, Fe2+.

Полярография — электрохимический метод качественного и количественного анализа и изучения кинетики химических процессов, предложенный в 1922 году чешским химиком Я. Гейровским. За разработку этого метода ему была присуждена в 1959 году Нобелевской премия по химии.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. Было выведено немецким физико-химиком Вальтером Нернстом.
Поляризация электрохимическая — изменение потенциала электрода от значения под током. Не следует путать перенапряжение с поляризацией, так как поляризация относится к электроду, а перенапряжение к реакции.

Алекса́ндр Нау́мович Фру́мкин — советский физикохимик, организатор науки, автор основополагающих работ в современной электрохимии; основоположник электрохимической кинетики, один из основателей современного учения об электрохимических процессах, создатель советской электрохимической научной школы.
Стеклянные электроды — тип ионоселективных электродов, сделанных из легированных стеклянных мембран, которые чувствительны к специфическим ионам, используемые для определения концентрации ионов в растворе. Важная часть приборов химического анализа и физико-химических исследований. В современной практике широко применяются мембранные ионоселективные электроды, являющиеся частью гальванического элемента. Электрический потенциал электродной системы в растворе чувствителен к изменению содержания определённого вида ионов, что выражается и в зависимости электродвижущей силы (ЭДС) гальванического элемента от концентрации этих ионов.
Окисли́тельно-восстанови́тельный элеме́нт — это гальванический элемент, состоящий из двух инертных электродов, опущенных в растворы солей с определенным окислительно-восстановительным потенциалом. Для этого элемента характерно то, что катионы и анионы, изменяя свой заряд, не выделяются на электродах и не появляются в растворе путём перехода вещества из электрода в раствор.
Электрохими́ческие суперконденса́торы — разновидность суперконденсаторов, в которой сохранение энергии происходит с участием обратимых окислительно-восстановительных электрохимических процессов в приповерхностном слое электродного материала.
Михаил Александрович Лошкарёв — доктор химических наук, профессор, создатель украинской научной школы гальванотехники.

Зиновий Александрович Иофа (1895—1990) — советский электрохимик, профессор, доктор химических наук.








