Соля́ная кислота́ — сильная неорганическая кислота. Раствор хлороводорода в воде.

Кислоро́д — химический элемент 16-й группы второго периода периодической системы Д. И. Менделеева с атомным номером 8.

Ма́рганец — химический элемент 7-й группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25.

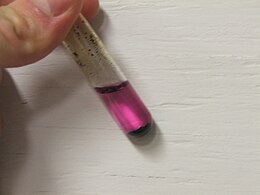
Пермангана́т ка́лия (лат. Kalii permanganas, распространённое название в быту — марганцо́вка) — марганцовокислый калий, калиевая соль марганцовой кислоты. Химическая формула — KMnO4. Представляет собой тёмно-фиолетовые, почти чёрные кристаллы, при растворении в воде образующие ярко окрашенный раствор цвета фуксии.

Гидрази́н  — неорганическое вещество, бесцветная, чрезвычайно токсичная, сильно гигроскопичная жидкость с неприятным запахом.
— неорганическое вещество, бесцветная, чрезвычайно токсичная, сильно гигроскопичная жидкость с неприятным запахом.

Циани́ды — соли цианистоводородной (синильной) кислоты. В номенклатуре IUPAC к цианидам относят также C-производные синильной кислоты — нитрилы.

Щаве́левая кислота — органическая кислота средней силы, относящаяся к классу предельных карбоновых кислот. Является простейшей двухосновной карбоновой кислотой.
Эквивале́нт вещества́ или просто эквивале́нт — реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-осно́вных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях.

Титриметрический анализ (титрование) — метод количественного/массового анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать начиная от других отметок не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования определяют с помощью индикаторов или физико-химическими методами. По количеству затраченного на титрование рабочего раствора рассчитывают результаты анализа.

Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота весьма токсична (в больших концентрациях). Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, многие из них - токсичны, канцерогенны.
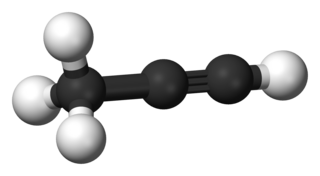
Пропи́н — органическое соединение, относящееся к классу непредельных углеводородов — алкинов.

Диаграмма Пурбе — диаграмма, наглядно отображающая термодинамически устойчивые формы существования элементов в растворах при различных значениях водородного показателя pH и окислительно-восстановительного потенциала E. Предложена Марселем Пурбе.

Марганцо́вая кислота́ — сильная, нестабильная, неорганическая кислота фиолетово-красного цвета с химической формулой  . В чистом виде не выделена, существует в виде раствора.
. В чистом виде не выделена, существует в виде раствора.

Окси́д ма́рганца(IV)  — порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре.
— порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре.
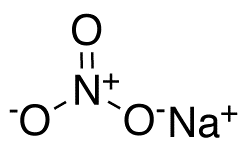
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.

Тиосульфа́ты — соли и сложные эфиры тиосерной кислоты, H2S2O3. Тиосульфаты неустойчивы, поэтому в природе не встречаются. Наиболее широкое применение имеют тиосульфат натрия и тиосульфат аммония.
Азотнова́тистая кислота́ — слабая, неустойчивая неорганическая кислота. Образует соли — гипонитриты.

Сульфи́д на́трия, традиционное название — серни́стый на́трий, — сложное неорганическое вещество, бинарное соединение с химической формулой  . Натриевая соль сероводородной кислоты.
. Натриевая соль сероводородной кислоты.

Манганат калия — сложное неорганическое вещество с химической формулой K2MnO4.

Экзергонические реакции, также самопроизвольные реакции — согласно второму началу термодинамики это химические реакции, которые протекают без притока энергии извне. Величина свободной энергии таких реакций всегда отрицательна, т.е. ΔG° < 0. Большинство химических реакций, которые протекают в окружающей среде — экзергонические, вследствие этого они являются термодинамически выгодными, в отличие от эндергонических. Примером экзергонических реакций являются процессы электролитической диссоциации, окисления и горения, сорбционные процессы, фотохимические процессы (фотодиссоциация), в живых организмах это процессы катаболизма — гликолиз, липолиз, протеолиз, окисление жирных кислот и многие другие.