
Аминокисло́ты, также аминокарбо́новые кисло́ты, АМК — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот . Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.

Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.

Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию сложных эфиров фосфорной кислоты:
- АТФ + R-OH → АДФ + R-OPO3H2

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
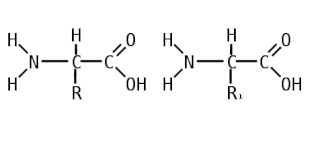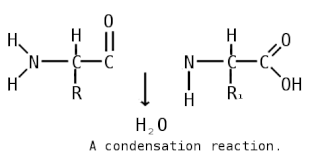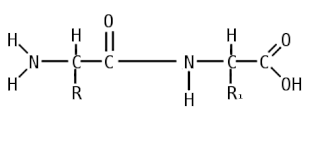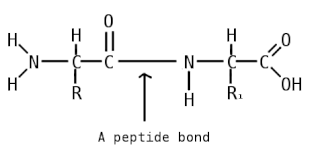
Пепти́ды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями −C(O)NH−. Обычно подразумеваются пептиды, состоящие из  -аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.
-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот.
Химическая эволюция или пребиотическая эволюция — этап, предшествовавший появлению жизни, в ходе которого органические, пребиотические вещества возникли из неорганических молекул под влиянием внешних энергетических и селекционных факторов и в силу развертывания процессов самоорганизации, свойственных всем относительно сложным системам, которыми, бесспорно, являются все углеродосодержащие молекулы.

Проли́н — гетероциклическая иминокислота, в которую атом азота входит в составе вторичного, а не первичного, амина. Существует в двух оптически изомерных формах — L и D, а также в виде рацемата.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.

Аспараги́н — амид аспарагиновой кислоты. Одна из 20 наиболее распространённых аминокислот природного происхождения. Их кодоны AAU и AAC.

Нуклеи́новая кислота — высокомолекулярное органическое соединение, биополимер (полинуклеотид), образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
Коллаге́н — гликопротеин, фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий её прочность и эластичность. Коллаген обнаружен у животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Коллаген — основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25 % до 45 % белков во всём теле. Синтез коллагена очень энергозатратен и происходит только у животных, которые используют кислород. Появление коллагена позволило создать скелет, как внешний, так и внутренний, и резко увеличить размеры животных во время кембрийского взрыва.
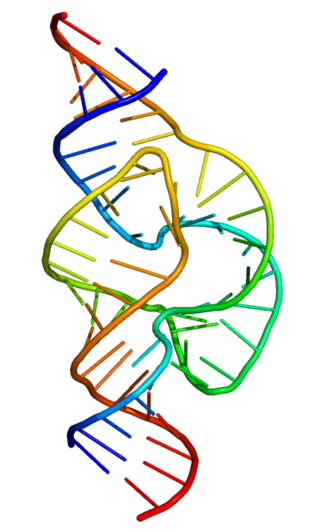
Мир РНК — гипотетический этап возникновения жизни на Земле, когда и функцию хранения генетической информации, и катализ химических реакций выполняли ансамбли молекул рибонуклеиновых кислот. Впоследствии из их ассоциаций возникла современная ДНК-РНК-белковая жизнь, обособленная мембраной от внешней среды. Идея мира РНК была впервые высказана Карлом Вёзе в 1968 году, позже развита Лесли Орджелом и окончательно сформулирована Уолтером Гильбертом в 1986 году.
Рибозим, также называемая ферментативной РНК или каталитической РНК — это молекула РНК, обладающая каталитическим действием. Многие рибозимы естественного происхождения катализируют расщепление самих себя или других молекул РНК, кроме того образование пептидной связи в белках происходит при помощи рРНК рибосомы. В рамках исследований, посвященных происхождению жизни, удалось создать искусственные рибозимы типа РНК-полимеразы, способные при определенных условиях катализировать свою собственную сборку. Первые лабораторные образцы показали невысокую каталитическую способность: они успевают собрать в цепочку не более 14 нуклеотидов за 24 часа, по истечении которых они разлагаются за счет гидролиза фосфодиэфирных связей, однако результат постепенно улучшается: в 2011 году достигнуто значение в 95 нуклеотидов.
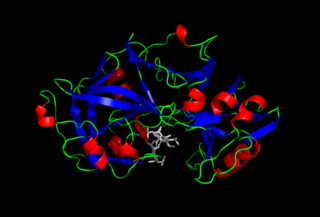
Пепси́н — протеолитический фермент класса гидролаз образуется из своего предшественника пепсиногена, вырабатываемого главными клетками слизистой оболочки желудка, и осуществляет расщепление белков пищи до пептидов. Присутствует в желудочном соке человека и других млекопитающих, птиц, пресмыкающихся и большинства рыб.
Вторичная структура — конформационное расположение главной цепи макромолекулы, независимо от конформации боковых цепей или отношения к другим сегментам. В описании вторичной структуры важным является определение водородных связей, которые стабилизируют отдельные фрагменты макромолекул.

Эксперимент Ми́ллера — Ю́ри — известный классический эксперимент, в котором моделировались гипотетические условия раннего периода развития Земли для проверки возможности химической эволюции. Фактически это был экспериментальный тест гипотезы, высказанной ранее Александром Опариным и Джоном Холдейном, о том, что условия, существовавшие на примитивной Земле, способствовали химическим реакциям, которые могли привести к синтезу органических молекул из неорганических. Был проведён в 1953 году Стэнли Миллером и Гарольдом Юри. Аппарат, спроектированный для проведения эксперимента, включал смесь газов, соответствующую представлениям о составе атмосферы ранней Земли в 1950-х, и пропускавшиеся через неё электрические разряды . Эксперимент Миллера — Юри считается одним из важнейших опытов в исследовании происхождения жизни на Земле. Первичный анализ показал наличие в конечной смеси 5 аминокислот. Однако более точный повторный анализ, опубликованный в 2008 году, показал, что эксперимент привёл к образованию 22 аминокислот.

Цисти́н — алифатическая серосодержащая аминокислота, бесцветные кристаллы, плохо растворимы в холодной воде (1:9000), растворимы в минеральных кислотах и органических растворителях.
Протобио́нты, или протокле́тки — гипотетический примитивный организм, который, согласно некоторым теориям происхождения жизни, возник бы из-за скопления органических веществ и представлял собой примитивную форму жизни, предшественницу клеток прокариот.
Мари́я Моисе́евна Ботви́ник — советский учёный-химик, доктор химических наук, специалист в области химии белка, в частности, оксиаминокислот. Впервые в России синтезировала важнейшие оксиаминокислоты и их производные, значительно продвинула химию в решении вопроса о роли гидроксила в белке, механизмах действия ферментов.

Структура белков — расположение атомов молекулы белка в трёхмерном пространстве. Белки являются полимерами — полипептидами, последовательностями, составленными из мономеров — различных L-α-аминокислот. Обычно белок, состоящий менее чем из 40 аминокислот, называют пептидом. Для того, чтобы осуществлять свои биологические функции, белки сворачиваются в одну или несколько особых пространственных конфигураций, обусловленных рядом нековалентных взаимодействий, таких, как водородные связи, ионные связи, силы Ван-дер-Ваальса. Для понимания того, как функционируют белки на молекулярном уровне, необходимо определить их трёхмерную структуру.














