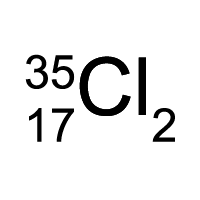Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.

Периоди́ческая систе́ма хими́ческих элеме́нтов — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Периодическая таблица была представлена независимо и почти одинаково двумя химиками в 1869 году: сначала русским Дмитрием Менделеевым, а через несколько месяцев немцем Лотаром Мейером и приведена к традиционному графическому виду в 1871 году. Всего предложено несколько сотен вариантов изображения периодической системы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Нобе́лий — химический элемент 3-й группы седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 102. Относится к семейству актиноидов.
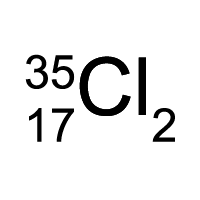
Символы химических элементов — условное обозначение химических элементов. Вместе с химическими формулами, схемами и уравнениями химических реакций образуют формальный язык химии — систему условных обозначений и понятий, предназначенную для краткой, ёмкой и наглядной записи и передачи химической информации.
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева.

Заря́довое число́ атомного ядра — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядра химического элемента в таблице Менделеева. Обычно обозначается буквой Z.
Спи́сок хими́ческих элеме́нтов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ, группа и период в Периодической системе химических элементов, относительная атомная масса элемента ; а также плотность, температура плавления, температура кипения простого вещества, и год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
Пери́од — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки, где в каждый период входят элементы с одинаковым количеством электронных оболочек.

Альтернативные периодические таблицы являются табличным представлением химических элементов, которое значительно отличается от организации элементов в Периодической таблице Менделеева. В настоящее время различными авторами предложено множество вариантов, которые в основном нацелены на дидактическое преподнесение материала, так как не все корреляции между химическими элементами видны из стандартной Периодической системы.
Подгру́ппа углеро́да — химические элементы 14-й группы периодической таблицы химических элементов . В группу входят углерод С, кремний Si, германий Ge, олово Sn, свинец Pb и недавно открытый искусственный радиоактивный элемент флеровий Fl.
В химии термин постпереходные металлы используется для описания категории химических элементов, которые по своим свойствам напоминают металлы. Постпереходные металлы располагаются справа от переходных металлов в периодической системе. ИЮПАК определяет нахождение переходных металлов в 3—11 группах или 3—12. В соответствии с первым утверждением, постпереходные металлы включают в себя 12-ю группу — цинк, кадмий и ртуть. В эту группу иногда включают и германий, сурьму и/или полоний, хотя они, как правило, являются металлоидами. Согласно второму определению данных элементов, двенадцатая группа не может быть включена в данную группу металлов. Изучение учебников и монографий в 2003 году показывает, что оба утверждения использовались с примерно одинаковой частотой.
Подгру́ппа ска́ндия — химические элементы 3-й группы периодической таблицы химических элементов. Ввиду особенностей строения электронной конфигурации элементов этой группы точный состав её в разных источниках имеет различия. ИЮПАК не даёт строгих рекомендаций по спецификациям формата периодической таблицы. Поэтому по составу группы 3 имеются и часто используются несколько конвенций. Следующие d-элементы из переходных металлов всегда считаются членами группы 3:

В 1869 году Дмитрий Иванович Менделеев опубликовал Периодическую таблицу элементов, в которой химические элементы были расположены в соответствии с наличием у них сходных свойств в порядке возрастания атомного веса.
К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы верхней строки периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) химических свойств элементов при увеличении атомного числа: новая строка начинается тогда, когда увеличивается количество энергетических уровней, что означает попадание элементов с аналогичными свойствами в тот же вертикальный столбец. Первый период содержит меньше всего элементов. Их всего два: водород и гелий. Данное положение объясняется современной теорией строения атома.
К четвёртому пери́оду периоди́ческой систе́мы относятся элементы четвёртой строки периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Четвёртый период содержит восемнадцать элементов, в него входят: калий, кальций, скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром и криптон. Первые два из них, калий и кальций, входят в s-блок периодической таблицы, десять следующих являются d-элементами, а остальные относятся к р-блоку. Следует обратить внимание, что заполненные 3d-орбитали появляются только у элементов 4 периода. Все элементы этого периода имеют стабильные изотопы, все они встречаются в природе.
К шесто́му пери́оду периоди́ческой систе́мы относятся элементы шестой строки периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Шестой период содержит 32 элемента, в том числе включает особую группу элементов — лантаноиды. В него входят: цезий, барий, лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций, гафний, тантал, вольфрам, рений, осмий, иридий, платина, золото, ртуть, таллий, свинец, висмут, полоний, астат и радон. В этом периоде содержится 9 переходных металлов, от гафния до ртути, иногда к их числу причисляют и лантан, который относят также и к лантаноидам. В триаде осмий — иридий — платина для осмия известна степень окисления +8. Астат имеет достаточно выраженный металлический характер. Радон, по всей вероятности, обладает наибольшей реакционной способностью из всех инертных газов. Из-за того, что он сильно радиоактивен, его химия мало изучена.
Восьмо́й пери́од периоди́ческой систе́мы включает гипотетические химические элементы, принадлежащие к дополнительной восьмой строке периодической системы. Систематизированные названия этих элементов переданы ИЮПАК к использованию. Ни один из этих элементов пока не был создан, и вполне возможно, что ни один из них не имеет изотопов с достаточно стабильными ядрами, чтобы синтезировать их в ближайшие годы. Возможно также, что в связи с капельной неустойчивостью ядер, только первые несколько элементов восьмого периода физически возможны.
К седьмо́му пери́оду периоди́ческой систе́мы относятся элементы седьмой строки периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Седьмой период содержит 32 элемента, в том числе включает особую группу элементов — актиноиды. В него входят: франций, радий, актиний, торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделеевий, нобелий, лоуренсий, резерфордий, дубний, сиборгий, борий, хассий, мейтнерий, дармштадтий, рентгений, коперниций, нихоний, флеровий, московий, ливерморий, теннессин и оганесон.

Список символов химических элементов — символы (знаки), коды или сокращения, используемые для краткого или наглядного представления наименований химических элементов и одноимённых простых веществ. Прежде всего это символы химических элементов и атомные номера в Периодической системе элементов. Помимо них, в локальных целях могут использоваться:
- регистрационный номер CAS — уникальный цифровой идентификатор химических элементов и веществ, внесённых в реестр Химической реферативной службы ;
- сокращения, используемые в российской металлургии при маркировке компонентов в составе сплавов цветных и чёрных металлов;
- символы, используемые в нумизматике для обозначения монетных металлов;
- символы, используемые на финансовом рынке для обозначения некоторых металлов в качестве валютных ценностей или биржевых товаров;
- символы алхимии;
- другие локальные системы кодирования и маркировки.
Унбитрий — временное систематическое название гипотетического химического элемента в группе трансурановых g-элементов-суперактиноидов в расширенном виде Периодической системы Д. И. Менделеева с временным обозначением Ubt, атомным номером 123 и расчётными массами изотопов в диапазоне 297—307.