
Хлори́д о́лова(IV) (тетрахлорстанна́н, тетрахлори́д о́лова, оловя́нное ма́сло, хло́рное о́лово, четырёххло́рное о́лово) — бинарное соединение олова и хлора с формулой SnCl4. Может рассматриваться как соль олова и соляной кислоты, а также как хлорпроизводное станнана.

Галогеноалканы (алкилгалогениды) — органические соединения, которые содержат в своём составе связь «углерод-галоген». Их строение можно представить, исходя из строения углеводорода, в котором связь С-Н заменена на связь С-Х,. В силу того, что атомы галогенов являются более электроотрицательными, чем атом углерода, связь С-Х поляризована таким образом, что атом галогена приобретает частичный отрицательный заряд, а атом углерода — частичный положительный. Соответственно, алкилгалогениды являются ярко выраженными электрофилами, и на этом свойстве основано их применение в органическом синтезе.

Хлорофо́рм (он же трихлормета́н, метилтрихлори́д, хладо́н 20) — органическое химическое соединение с формулой CHCl3. При нормальных условиях — бесцветная летучая жидкость c эфирным запахом и сладким вкусом. Практически нерастворим в воде — образует с ней растворы с массовой долей до 0,23 %, — смешивается с большинством органических растворителей. Негорюч. Возможны отравления фосгеном при работе с хлороформом, который долго хранился на свету в тёплом месте.

Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс — химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующиеся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).

Галоге́ны — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева.

Фтóроводоро́д (гидрофтори́д, фтóристый водорóд, фтори́д водорóда, HF) — бесцветный газ (при стандартных условиях) с резким неприятным запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF. Токсичен, ПДКр.з. = 0,5 мг/м³, II класс опасности (высокоопасные вещества) в соответствии с ГОСТ 12.1.007-76.
Фтороргани́ческие соедине́ния — галогенорганические соединения, содержащие хотя бы один атом фтора, соединённый напрямую с углеродом.

Тетрафтормета́н — бинарное химическое соединение. Химическая формула — CF4. Другие названия — четырёхфтористый углерод, тетрафторид углерода. Коммерческие названия соединения при использовании в качестве хладагента: фреон-14, хладон-14.

Лев Моисе́евич Ягупо́льский — советский и украинский учёный, химик-органик, специалист в области химии фторорганических соединений, основатель киевской школы химии фтора. Доктор химических наук, профессор, работал научным сотрудником Института органической химии НАНУ, заслуженный деятель науки УССР. Участник Великой Отечественной войны, кавалер ордена Отечественной войны II степени, ордена «За заслуги» (Украина) III степени, лауреат государственных премий СССР и Украины.

Дифторхлорметан (также Фреон R-22, Хладагент R-22, Хладон-22) — фреон, химическая формула CHClF2. Бесцветный газ со слабым запахом хлороформа, более ядовит, чем R-12, не взрывоопасен и не горюч. По сравнению с R-12, хладагент R-22 хуже растворяется в масле, но легко проникает через неплотности и нейтрален к металлам. При температуре выше 330 °C в присутствии металлов разлагается с выделением токсичных веществ.

Фторид нитрила — неорганическое соединение, соль, образуемая нитроил-ионом и остатком фтористоводородной кислоты с формулой (NO2)F, бесцветный газ, реагирует с водой.

Фторид сурьмы(V) — бинарное неорганическое соединение сурьмы и фтора с формулой SbF5, бесцветная маслянистая жидкость, энергично реагирует с водой.
Реакция Саймонса — это электрохимическое фторирование органических соединений в безводном жидком фтористом водороде. Способ электрохимического фторирования разработан американским химиком Джоном Саймонсом в 1948 году и использован для промышленного получения перфторорганических соединений. Для проведения электрохимического фторирования органическое соединение растворяют в безводном жидком фтористом водороде при температуре около 0° C и создают электропроводящий раствор добавкой фторида калия или другого диссоциирующего на ионы в этом растворителе соединения. Электролиз ведут при постоянном напряжении около 6 вольт. Материал анода — никель.
Хлорфторуглероды — органические соединения, состоящие исключительно из атомов хлора (Cl), фтора (F) и углерода (С). Различают низшие хлорфторуглероды (CFC) — низкокипящие органические соединения на основе метанового, этанового и пропанового рядов, а также высшие хлорфторуглероды, являющиеся высокомолекулярными соединениями.
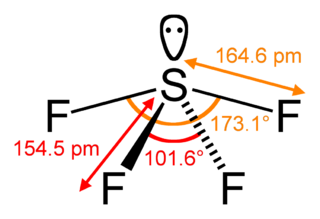
Тетрафторид серы (фторид серы(IV)) — неорганическое соединение с формулой SF4, бесцветный газ, реагирует с водой.
Трифтори́д-окси́д бро́ма — неорганическое соединение брома, фтора и кислорода с формулой BrOF3, бесцветная жидкость.

Трифторсилан — неорганическое соединение, фторпроизводное моносилана с формулой SiHF3, бесцветный газ.

1,1-Дифторэтилен (винилиденфторид) — вещество, относящееся к фторолефинам — алкенам, в которых один или несколько атомов водорода замещены атомами фтора. Является непредельным фторорганическим соединением и служит в качестве мономера для синтеза термостойких и химически стойких полимеров и сополимеров.

1,1,2-Трифтор-2-хлорэтилен — относится к фторолефинам — алкенам, в которых один или несколько атомов водорода замещены атомами фтора. Является непредельным фторорганическим соединением и служит в качестве мономера (Мономер-3) для производства фторкаучука СКФ-32 — сополимера с Мономером-2.

Фторид кюрия(III) — бинарное неорганическое соединение кюрия и фтороводородной кислоты. Представляет собой бесцветные кристаллы, малорастворимые в воде.

















