Дыхательная цепь переноса электронов, также электрон-транспортная цепь (сокр. ЭТЦ, англ. ETC, Electron transport chain) — система трансмембранных белков и переносчиков электронов, необходимых для поддержания энергетического баланса. ЭТЦ поддерживает баланс за счёт переноса электронов и протонов из НАД∙Н и ФАДН2 в акцептор электронов. В случае аэробного дыхания акцептором может быть молекулярный кислород (О2). В случае анаэробного дыхания акцептором могут быть NO3−, NO2−, Fe3+, фумарат, диметилсульфоксид, сера, SO42−, CO2 и т. д. ЭТЦ у прокариот локализована в ЦПМ, у эукариот — на внутренней мембране митохондрий. Переносчики электронов расположены в порядке уменьшения сродства к электрону, то есть по своему окислительно-восстановительному потенциалу, где у акцептора самое сильное сродство к электрону. Поэтому транспорт электрона на всём протяжении цепи протекает самопроизвольно с выделением энергии. Выделение энергии в межмембранное пространство при переносе электронов происходит ступенчато, в виде протона (H+). Протоны из межмембранного пространства попадают в протонную помпу, где наводят протонный потенциал. Протонный потенциал преобразуется АТФ-синтазой в энергию химических связей АТФ. Сопряжённая работа ЭТЦ и АТФ-синтазы носит название окислительного фосфорилирования.

Протеасо́ма — многобелковый комплекс, разрушающий ненужные или дефектные белки при помощи протеолиза до коротких пептидов. Эти пептиды затем могут быть расщеплены до отдельных аминокислот. Протеасомы присутствуют в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для убиквитинлигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка.

Факторы транскрипции — белки́, контролирующие процесс синтеза мРНК, а также других видов РНК на матрице ДНК (транскрипцию) путём связывания со специфичными участками ДНК. Транскрипционные факторы выполняют свою функцию либо самостоятельно, либо в комплексе с другими белками. Они обеспечивают снижение (репрессоры) или повышение (активаторы) константы связывания РНК-полимеразы с регуляторными последовательностями регулируемого гена.

P-гликопротеин, или белок множественной лекарственной устойчивости 1, — мембранный белок, гликопротеин из семейства ABC-переносчиков. Обеспечивает перенос многих веществ, таких как липиды, стероиды, пептиды, билирубин и др., через мембрану клетки. Продукт гена ABCB1.
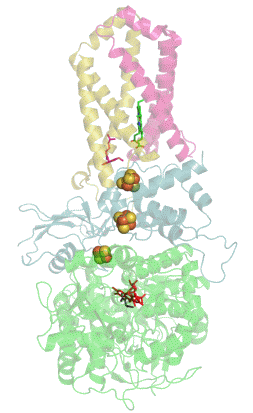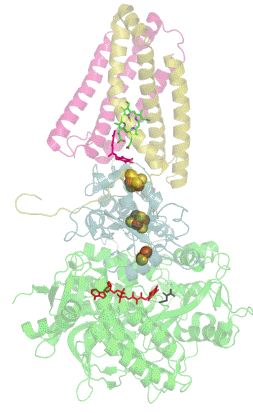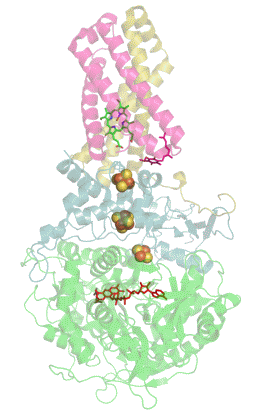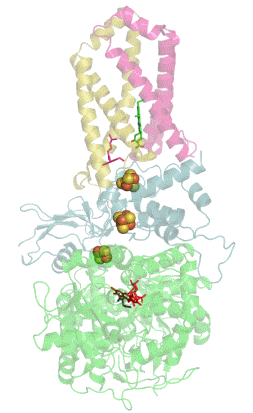
Сукцинатдегидрогеназа или сукцинат-убихинон-оксидорекдуктаза, также известная как комплекс II — белковый комплекс, расположенный во внутренней мембране митохондрий и мембранах многих прокариотических организмов. Одновременно участвует в цикле трикарбоновых кислот и дыхательной цепи переноса электронов.
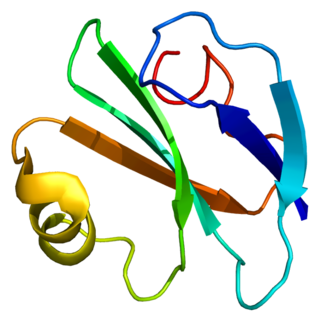
Гликопротеин CD59, ингибитор мембраноатакующего комплекса, или протектин — мембранный белок, регуляторный белок системы комплемента. Продукт гена человека CD59.

Бромодоменсодержащий белок 4 — хроматинсвязывающий белок, который у человека кодируется геном BRD4. Он узнаёт и связывается с остатками ацетилированного лизина в составе гистонов и других белков. BRD4 принимает участие в регуляции транскрипции и передаче эпигенетической информации при делении клетки. В 2016 году было установлено, что BRD4 обладает собственной гистонацетилтрансферазной активностью.

Фотосисте́ма II (втора́я фотосисте́ма, фотосисте́ма два, ФСII), или H2O-пластохиноноксидоредуктаза — первый функциональный комплекс электрон-транспортной цепи (ЭТЦ) хлоропластов. Он расположен в мембранах тилакоидов всех растений, водорослей и цианобактерий. Поглощая энергию света в ходе первичных фотохимических реакций, он формирует сильный окислитель — димер хлорофилла a (П680+), который через цепь окислительно-восстановительных реакций способен вызвать окисление воды.
Е-бокс — ДНК-последовательность, найденная в некоторых промоторных областях у эукариот, которые действует в качестве связывающего сайта белка и, как было установлено, регулируют экспрессию генов в нейронах, мышцах и других тканях. Спецификация такой ДНК-последовательности — CANNTG, с палиндромной канонической последовательностью. CACGTG распознаётся и связывается факторами транскрипции для инициации транскрипции генов. После того, как факторы транскрипции связываются с промоторами через E-бокс, другие ферменты могут связываться с промотором и облегчать транскрипцию мРНК из ДНК.
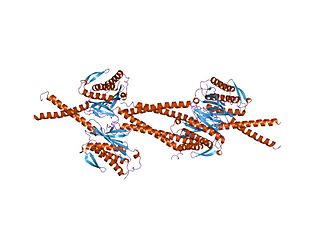
Mad1 — белок дрожжей и других эукариот, который участвует в прохождении контрольной точки сборки веретена деления. Эта контрольная точка контролирует прикрепление микротрубочек к хромосомам и препятствует вхождению клетки в анафазу до тех пор, пока веретено деления не будет полностью собрано. Название Mad дано за то, что у клеток, мутантных по этому белку, наблюдается дефектность блокировки митоза при деполимеризации микротрубочек. MAD1 рекрутирует ингибитор анафазы Mad2 к свободным кинетохорам, не соединившимся с микротрубочками веретена, и имеет важное значение для образования комплекса Mad2-Cdc20 in vivo, но не in vitro. In vivo Mad1 действует как конкурентный ингибитор комплекса Mad2-Cdc20. Mad1 фосфорилируется киназой Mps1, что вместе с другими процессами приводит к формированию комплекса митотической контрольной точки. Таким образом он ингибирует активность комплекса стимуляции анафазы/циклосомы (APC/C). Гомологи Mad1 эволюционно консервативны у эукариот от дрожжей до млекопитающих. Регулируя клеточный цикл и расхождение хромосом, а также выполняя некоторые интерфазные функции, Mad1 оказывается вовлечённым в развитие многих опухолей и генетических заболеваний.

Сурвивин, также бакуловирусный ингибитор мотива апоптозных повторов 5, сокращённо BIRC5 — белок, кодируемый у человека геном BIRC5.

Mad2 является важным белком контрольной точки веретена деления. Система контрольной точки веретена деления является системой регулирования, сдерживающей прогрессирование перехода от метафазы к анафазе. Ген Mad2 был впервые выявлен в дрожжах S. cerevisiae в скрининге для генов, мутированных для придания им чувствительности к ядам микротрубочек. Человеческие ортологи Mad2 были впервые выделены в поисках человеческих кДНК, которые спасают микротрубочки ядочувствительного штамма дрожжей, в котором отсутствовал белок, связывающий кинетохор. Было показано, что белок был представлен в одиноких кинетохорах, и исследование ингибирования антител показало, что он имеет важное значение для выполнения блока перехода от метафазы к анафазе в ответ на отравление микротрубочек нокодазолом. После выделения ортолога Xenopus Laevis , подобного человеческим последовательностям, появилась возможность охарактеризовать митотическую контрольную точку в экстрактах яиц.

НАДН-дегидрогена́зный ко́мплекс, также называемый ко́мплекс I или НАДН-убихино́н-оксидоредукта́за — первый мультибелковый комплекс дыхательной цепи переноса электронов. Множество копий комплекса расположены в мембранах прокариотических организмов, способных к кислородному дыханию и внутренних мембранах митохондрий эукариотических клеток. По отношению к белкам человека комплекс I часто называют НАДН-дегидрогеназой.

Пренилирование — биохимический процесс присоединения гидрофобных молекул к белку или другому химическому веществу. Обычно считается, что пренильные группы (3-метилбут-2-ен-1-ил) облегчают присоединение молекул к клеточным мембранам, также как, «липидные якорные белки», такие как, например, гликозилфосфатидилинозитол, хотя прямое доказательство этого пока не найдено. Доказано, что пренильные группы являются важным элементом для протеин-протеиновой связи посредством специальных пренил-связывающих доменов.
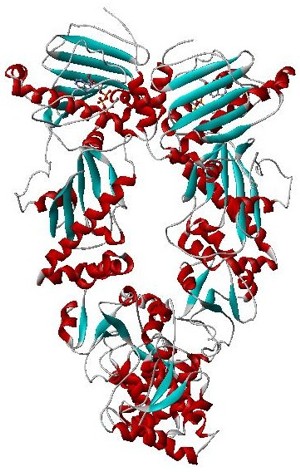
Hsp90, также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться, стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.

Рецептор урокиназы — гликопротеин, рецептор, заякоренный на клеточной мембране гликозилфосфатидилинозитолом. Исторически был обнаружен как насыщаемый участок связывания урокиназы на поверхности клетки.
Белок 1, подобный рецептору липопротеинов низкой плотности, или рецептор для α2-микроглобулина, или рецептор аполипопротеина E — мембранный белок семейства рецепторов липопротеинов низкой плотности, участвующий в рецептор-опосредованном эндоцитозе. Продукт гена человека LRP1 LRP1 является сигнальным белком, играющим роль во многих биологических процессах, включая метаболизм липопротеинов, клеточная подвижность и в таких патологиях, как нейродегенеративные заболевания, атеросклероз и рак

B-Raf, или c-RAF — цитозольная серин/треониновая протеинкиназа семейства MAP3K. Продукт протоонкогена B-Raf BRAF.

Класси́ческий пу́ть актива́ции систе́мы комплеме́нта — один из трёх путей активации системы комплемента, наряду с альтернативным путём и лектиновым путём. Классический путь запускают комплексы антиген-антитело, причём антитела должны принадлежать к классу IgG или IgM. После активации происходит сборка белкового комплекса C3-конвертазы (C4b2b), который разрезает белок комплемента C3. Один из фрагментов C3, C3b, связывается с C3-конвертазой, в результате чего образуется C5-конвертаза (C4b2b3b). C5-конвертаза разрезает компонент комплемента 5, после чего образовавшиеся белковые фрагменты привлекают фагоциты в очаг инфекции и способствуют поглощению клеток патогенов. C5-конвертаза также запускает финальные стадии каскада комплемента, которые завершаются формированием мембраноатакующего комплекса. Он формирует поры в мембране клетки микроорганизма, вызывая её лизис и гибель. Помимо микробных клеток, классический путь комплемента могут запускать апоптотические тельца и некротизированные клетки.

















