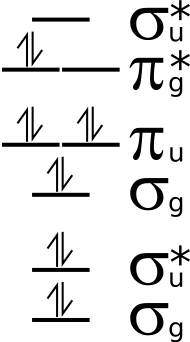Ква́нтовая тео́рия по́ля (КТП) — раздел физики, изучающий поведение квантовых систем с бесконечно большим числом степеней свободы — квантовых полей; является теоретической основой описания микрочастиц, их взаимодействий и превращений. На языке КТП основываются физика высоких энергий и физика элементарных частиц, её математический аппарат используется в физике конденсированного состояния. КТП в виде Стандартной модели в настоящее время является единственной экспериментально подтверждённой теорией, способной описывать и предсказывать результаты экспериментов при достижимых в современных ускорителях высоких энергиях.
Метод ренормализационной группы в квантовой теории поля — итеративный метод перенормировки, в котором переход от областей с меньшей энергией к областям с большей вызван изменением масштаба рассмотрения системы.

Ква́нтовая электродина́мика (КЭД) — квантовополевая теория электромагнитных взаимодействий; наиболее разработанная часть квантовой теории поля. Классическая электродинамика учитывает только непрерывные свойства электромагнитного поля, в основе же квантовой электродинамики лежит представление о том, что электромагнитное поле обладает также и прерывными (дискретными) свойствами, носителями которых являются кванты поля — фотоны. Взаимодействие электромагнитного излучения с заряженными частицами рассматривается в квантовой электродинамике как поглощение и испускание частицами фотонов.

Волна́ — изменение некоторой совокупности физических величин, которое способно перемещаться, удаляясь от места их возникновения, или колебаться внутри ограниченных областей пространства.
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в другие вещества (продукты), при котором ядра атомов не меняются, при этом происходит перераспределение электронов и ядер, и образуются новые химические вещества. В отличие от ядерных реакций, при химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.
Криохимия — раздел химии, который изучает превращения в жидкой и твёрдой фазах при низких и сверхнизких температурах. По изучаемым явлениям имеет пересечения с физикой конденсированных сред и астрохимией.
Физи́ческая кине́тика — микроскопическая теория процессов в неравновесных средах. В кинетике методами квантовой или классической статистической физики изучают процессы переноса энергии, импульса, заряда и вещества в различных физических системах и влияние на них внешних полей. В отличие от термодинамики неравновесных процессов и электродинамики сплошных сред, кинетика исходит из представления о молекулярном строении рассматриваемых сред, что позволяет вычислить из первых принципов кинетические коэффициенты, диэлектрические и магнитные проницаемости и другие характеристики сплошных сред. Физическая кинетика включает в себя кинетическую теорию газов из нейтральных атомов или молекул, статистическую теорию неравновесных процессов в плазме, теорию явлений переноса в твёрдых телах и жидкостях, кинетику магнитных процессов и теорию кинетических явлений, связанных с прохождением быстрых частиц через вещество. К ней же относятся теория процессов переноса в квантовых жидкостях и сверхпроводниках и кинетика фазовых переходов.
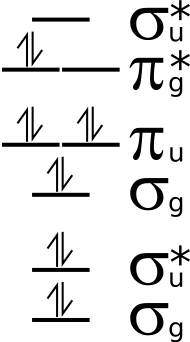
Сингле́тный кислоро́д — общее название для двух метастабильных состояний молекулярного кислорода (O2) с более высокой энергией, чем в основном, триплетном состоянии. Энергетическая разница между самой низкой энергией O2 в синглетном состоянии и наименьшей энергией триплетного состояния составляет около 11400 кельвин (Te (a1Δg ← X3Σg−) = 7918,1 см−1), или 0,98 эВ. Открыт Х. Каутским.
Тепловой эффект химической реакции — изменение внутренней энергии  или энтальпии
или энтальпии  системы вследствие протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
системы вследствие протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом является работа против внешнего давления,
- как исходные вещества, так и продукты реакции имеют одинаковую температуру.
Космологические модели — модели, описывающие развитие Вселенной как целого.
Уравнение Лейдлера — Эйринга — уравнение, описывающее зависимость константы скорости химической реакции от полярности растворителя. Выражается в виде
Уравнение Димрота — Рейнхардта — уравнение, описывающее зависимость константы скорости химической реакции от полярности растворителя. Предложено Димротом по результатам исследования влияния растворителей на цветность бетаина.
Переходное состояние — промежуточное состояние в ходе химической реакции, при котором атомы принимают определенную конфигурацию вдоль реакционной координаты. Другими словами, переходное состояние — это состояние химической системы промежуточное между исходными веществами и продуктами реакции. Переходное состояние соответствует наивысшей энергии вдоль данной координаты реакции. При этом принимается допущение о идеальной необратимости реакции, при которой система пришедшая из конфигурации реагентов в переходное состояние больше не возвращается к исходным веществам, а превращается только в продукты.
Фазовые переходы второго рода — фазовые переходы, при которых вторые производные термодинамических потенциалов по давлению и температуре изменяются скачкообразно, тогда как их первые производные изменяются постепенно. Отсюда следует, в частности, что энергия и объём вещества при фазовом переходе второго рода не изменяются, но изменяются его теплоёмкость, сжимаемость, различные восприимчивости и т. д.
Реакции нуклеофильного замещения — реакции замещения, в которых атаку осуществляет нуклеофил — реагент, несущий неподеленную электронную пару. Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг.
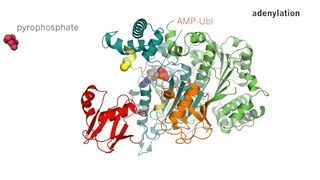
Ферментативный катализ — это увеличение скорости процесса с помощью биологической молекулы, «фермента». Большинство ферментов представляют собой белки, и большинство таких процессов представляют собой химические реакции. Внутри фермента катализ обычно происходит в локализованном центре, называемом активным центром.
Стереоселективность — преимущественное образование в химической реакции одного стереоизомера над другим. Если образующиеся стереоизомеры являются энантиомерами, то данное явление называется энантиоселективностью, если стереоизомерные продукты являются диастереомерами — диастереоселективностью. Количественно стереоселективность выражается при помощи энантиомерного или диастереомерного избытка.

Звёзды различных масс и возрастов обладают различной внутренней структурой. Модели строения звезды подробно описывают внутреннюю структуру звезды и предоставляют подробные сведения о светимости, цвете и дальнейшей эволюции звезды.

Джордж Симс Хэммонд — американский химик-теоретик, внёс большой вклад в развитие изучения фотохимии органических соединений, автор «Постулата Хэммонда» в теории переходного состояния в реакциях органической химии. Также известен своим вкладом в философию науки. Лауреат Премии Норриса 1968, Медали Пристли 1976, Национальной научной медали США, Золотой Медали Отмэра 2003. Был в должности председателя Allied Chemical Corporation с 1979 по 1989 год. Хэммонд получил степень бакалавра в Бэйтс-колледже в 1943 году, степень доктора наук в Гарвардском университете в 1947 году, работал в Оксфордском университете, в Базельском университете, в Национальном научном фонде США, в Калифорнийском технологическом институте, впоследствии возглавлял в нём одновременно химический факультет и факультет химической инженерии. С 1974 по 1978 он работал начальником отдела иностранных связей в национальной академии наук США.