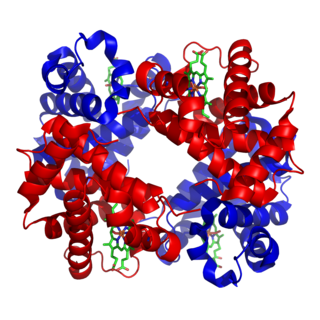
Гемоглоби́н — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1,34 мл кислорода.

Кле́точное ядро́ — окружённая двумя мембранами важная структура эукариотической клетки. В клетках прокариот ядра нет. В клетках эукариот обычно одно ядро, однако некоторые типы клеток, например, эритроциты млекопитающих, не имеют ядра, а другие содержат несколько ядер.

Цитозо́ль — жидкое содержимое клетки. Большую часть цитозоля занимает внутриклеточная жидкость. Цитозоль разбивается на компартменты при помощи разнообразных мембран. У эукариот цитозоль располагается под плазматической мембраной и является частью цитоплазмы, в которую, помимо цитозоля, входят митохондрии, пластиды и другие органеллы, но не содержащаяся в них жидкость и внутренние структуры. Таким образом, цитозоль представляет собой жидкий матрикс, окружающий органеллы. У прокариот большая часть химических реакций метаболизма происходит в цитозоле, и лишь небольшая их часть происходит в мембранах и периплазматическом пространстве. У эукариот, хотя многие реакции протекают в органеллах, некоторые реакции, например, гликолиз или синтез жирных кислот, происходят в цитозоле.

Окисли́тельное фосфорили́рование — метаболический путь, при котором энергия, образовавшаяся при окислении питательных веществ, запасается в митохондриях клеток в виде АТФ. Хотя различные формы жизни на Земле используют разные питательные вещества, АТФ является универсальным соединением, в котором запасается энергия, необходимая для других метаболических процессов. Почти все аэробные организмы осуществляют окислительное фосфорилирование. Вероятно, широкому распространению этого метаболического пути способствовала его высокая энергетическая эффективность по сравнению с анаэробным брожением.

Протеасо́ма — многобелковый комплекс, разрушающий ненужные или дефектные белки при помощи протеолиза до коротких пептидов. Эти пептиды затем могут быть расщеплены до отдельных аминокислот. Протеасомы присутствуют в клетках эукариот, архей и некоторых бактерий. В эукариотических клетках протеасомы содержатся и в ядре, и в цитоплазме. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы. Для того чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для убиквитинлигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени. В целом вся эта система получила название убиквитин-зависимой деградации белка.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот, имеющих гидроксильные группы или гетероциклической аминогруппы гистидина.
Искусственная кровь — общее название для целого ряда кровезаменителей, призванных выполнить и улучшить функции традиционной донорской крови. Особо интенсивные научно-исследовательские работы в данном направлении, хотя и разными методами, до и особенно после 2000 года начали вести группы учёных из России, Японии, США, Швеции, Германии и других стран.
S-слой, или паракристалли́ческий пове́рхностный слой, или пове́рхностный S-слой — структурированный слой, выстилающий поверхность клеточной оболочки многих прокариот и состоящий из равномерно упакованных белковых субъединиц. S-слои выявлены у ряда грамположительных и грамотрицательных бактерий, однако наибольшее распространение они получили у архей. У бактерий очень редки случаи, когда S-слой является единственной плотной оболочкой, обычно он сосуществует вместе с пептидогликановой клеточной стенкой. S-слой не играет формообразующей роли и часто утрачивается бактериями, растущими в лабораторных условиях.
Лакто́зный репре́ссор — ДНК-связывающий белок, который ингибирует экспрессию генов, кодирующих белки лактозного оперона. Кодируется геном lacI. Белки лактозного оперона участвуют в метаболизме лактозы в клетках бактерий. Эти гены подавляются, когда лактоза недоступна клеткам, гарантируя, что бактериальная клетка не будет тратить энергию на синтез белков, метаболизирующих лактозу, в условиях её отсутствия. Когда лактоза становится доступной, она преобразуется в аллолактозу, которая ингибирует способность лактозного репрессора связываться с ДНК. Когда репрессор не связан с оператором лактозного оперона, начинаются его транскрипция и последующий синтез ферментов метаболизма лактозы.
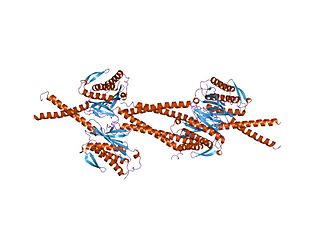
Mad1 — белок дрожжей и других эукариот, который участвует в прохождении контрольной точки сборки веретена деления. Эта контрольная точка контролирует прикрепление микротрубочек к хромосомам и препятствует вхождению клетки в анафазу до тех пор, пока веретено деления не будет полностью собрано. Название Mad дано за то, что у клеток, мутантных по этому белку, наблюдается дефектность блокировки митоза при деполимеризации микротрубочек. MAD1 рекрутирует ингибитор анафазы Mad2 к свободным кинетохорам, не соединившимся с микротрубочками веретена, и имеет важное значение для образования комплекса Mad2-Cdc20 in vivo, но не in vitro. In vivo Mad1 действует как конкурентный ингибитор комплекса Mad2-Cdc20. Mad1 фосфорилируется киназой Mps1, что вместе с другими процессами приводит к формированию комплекса митотической контрольной точки. Таким образом он ингибирует активность комплекса стимуляции анафазы/циклосомы (APC/C). Гомологи Mad1 эволюционно консервативны у эукариот от дрожжей до млекопитающих. Регулируя клеточный цикл и расхождение хромосом, а также выполняя некоторые интерфазные функции, Mad1 оказывается вовлечённым в развитие многих опухолей и генетических заболеваний.
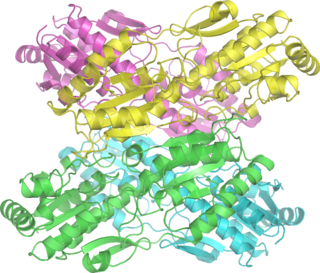
Фосфофруктокиназа-1 — фермент-фосфофруктокиназа, один из наиболее важных регуляторных ферментов. Отвечает за важный этап гликолиза, катализируя перенос фосфатной группы от молекулы АТФ к фруктозо-6-фосфату, в результате чего образуется фруктозо-1,6-бисфосфат и АДФ.

Гомотетрамер — вид четвертичной структуры белка, в которой белковый комплекс состоит из четырёх одинаковых субъединиц, связанных нековалентно.

Гетеротетраме́р — четвертичная структура белка в которой белковый комплекс состоит из четырёх не идентичных и не ковалентно связанных субъединиц. Гомотетрамер содержит четыре идентичные субъединицы.
Ацил-КоА-дегидрогеназы, также ACADs — семейство ферментов из класса оксидоредуктаз, которые катализируют реакции переноса протона (дегидрогенизация) от субстрата — ацил-КоА жирной кислоты на электрон-переносящий флавопротеин (FAD), участвуют в процессе β-окисления. Результатом реакции является образование двойной связи расположенной между атомами С2 (α) и С3 (β) в молекуле тиоэфира субстрата (ацил-КоА).

Иммуноглобули́ны M (IgM) — класс антител. Молекулы IgM являются самыми тяжёлыми и наиболее сложно организованными иммуноглобулинами. Молекула свободного IgM представляет собой пентамер, каждый мономер которого состоит из двух тяжёлых цепей (μ-цепей) и двух лёгких цепей κ- или λ-типов. Мономеры объединены в пентамер посредством дисульфидных мостиков и J-цепи. При первичном попадании в организм антигена иммуноглобулины IgM из всех антител образуются первыми. Кроме того, они первыми появляются в онто- и филогенезе. У человека и других млекопитающих IgM синтезируются плазматическими клетками, находящимися в селезёнке. IgM наиболее активны в антибактериальном иммунитете и при ряде аутоиммунных заболеваний.

Рецептор интерлейкина 10, бета-субъединица — белок, субъединица рецептора интерлейкина 10, продукт гена человека IL10RB.

Класси́ческий пу́ть актива́ции систе́мы комплеме́нта — один из трёх путей активации системы комплемента, наряду с альтернативным путём и лектиновым путём. Классический путь запускают комплексы антиген-антитело, причём антитела должны принадлежать к классу IgG или IgM. После активации происходит сборка белкового комплекса C3-конвертазы (C4b2b), который разрезает белок комплемента C3. Один из фрагментов C3, C3b, связывается с C3-конвертазой, в результате чего образуется C5-конвертаза (C4b2b3b). C5-конвертаза разрезает компонент комплемента 5, после чего образовавшиеся белковые фрагменты привлекают фагоциты в очаг инфекции и способствуют поглощению клеток патогенов. C5-конвертаза также запускает финальные стадии каскада комплемента, которые завершаются формированием мембраноатакующего комплекса. Он формирует поры в мембране клетки микроорганизма, вызывая её лизис и гибель. Помимо микробных клеток, классический путь комплемента могут запускать апоптотические тельца и некротизированные клетки.

В биохимии аллостерическая регуляция — это регуляция фермента путем связывания эффекторной молекулы в сайте, отличном от активного сайта фермента.
Стрептавидин представляет собой белок массой 66,0 (тетрамер) кДа, очищенный из бактерии Streptomyces avidinii. Гомотетрамеры стрептавидина обладают чрезвычайно высоким сродством к биотину (также известному как витамин B7 или витамин H). При константе диссоциации (Kd) порядка ≈10-14 моль/л связывание биотина со стрептавидином является одним из самых сильных нековалентных взаимодействий, известных в природе. Стрептавидин широко используется в молекулярной биологии и бионанотехнологии из-за устойчивости стрептавидин-биотинового комплекса к органическим растворителям, денатурантам (например, хлориду гуанидиния), детергентам (например, SDS, Triton X-100), протеолитические ферменты и экстремальные значения температуры и pH.
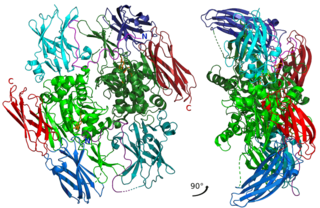
Фактор свёртывания крови XIII, протрансглутаминаза, также фибрин-стабилизирующий фактор или фактор Лаки-Лоранда — представляет собой белок зимоген, обнаруженный в крови человека и некоторых других животных. Он активируется тромбином, путём частичного протеолиза молекул зимогена до фактора XIIIa или трансглутаминазу. Фактор XIIIa представляет собой фермент системы свёртывания крови, сшивающий растворимые молекулы фибрина-мономера, превращая его в более прочную и нерастворимую форму — фибрин-полимер. Дефицит фактора XIII ухудшает стабильность сгустка и увеличивает склонность к кровотечениям. Впервые обнаружен в 1948 году венгерскими биохимиками, изучавшими процесс коагуляции крови — Калманом Лаки и Лазло Лорандом.













