
Се́рная кислота́ (химическая формула — H2SO4) — сильная неорганическая кислота, отвечающая высшей степени окисления серы (+6).
Гидрокси́ды — неорганические соединения, содержащие гидроксильную группу  . Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов.
. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов.

Фтóроводоро́д (гидрофтори́д, фтóристый водорóд, фтори́д водорóда, HF) — бесцветный газ (при стандартных условиях) с резким неприятным запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF. Токсичен, ПДКр.з. = 0,5 мг/м³, II класс опасности (высокоопасные вещества) в соответствии с ГОСТ 12.1.007-76.

Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота весьма токсична (в больших концентрациях). Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, многие из них - токсичны, канцерогенны.

Аммоний — полиатомный катион с химической формулой  . Аммоний с анионами образует соли аммония, аммониевые соединения, последние входят в большой класс ониевых соединений. Ион аммония NH4+ является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра. Размер иона — 1,43 Å.
. Аммоний с анионами образует соли аммония, аммониевые соединения, последние входят в большой класс ониевых соединений. Ион аммония NH4+ является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра. Размер иона — 1,43 Å.

Бро́моводоро́д — неорганическое вещество, бинарное соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
Бора́ты — соли борной кислоты.

Сульфи́д на́трия, традиционное название — серни́стый на́трий, — сложное неорганическое вещество, бинарное соединение с химической формулой  . Натриевая соль сероводородной кислоты.
. Натриевая соль сероводородной кислоты.

Оксид серебра(I) — химическое соединение с формулой Ag2O.

Фтори́д бери́ллия — бинарное неорганическое химическое соединение бериллия и фтора, химической формулой BeF2, бериллиевая соль фтористоводородной кислоты. Токсичен и канцерогенен, как и все соединения бериллия. Попадание пыли, содержащей галогениды, оксид и другие соединения бериллия, в лёгкие вызывает бериллиоз.
Тетрафторобора́т на́трия — неорганическое соединение, соль щелочного металла натрия и борофтористоводородной кислоты с формулой Na[BF4], бесцветные кристаллы, хорошо растворимые в воде.

Фторид германия(II) — бинарное неорганическое соединение металла германия и фтора с формулой GeF2, бесцветные (белые) кристаллы, растворяются в воде.

Фторид аммония — неорганическое соединение, соль аммония и фтористоводородной кислоты с формулой NH4F, бесцветные кристаллы, растворимые в воде, образует кристаллогидрат.

Окси́д-сульфа́т тита́на — неорганическое соединение, оксосоль металла титана и серной кислоты с формулой  бесцветные с желтоватым оттенком кристаллы, растворимые в воде, образует кристаллогидраты.
бесцветные с желтоватым оттенком кристаллы, растворимые в воде, образует кристаллогидраты.

Хлори́д цирко́ния(IV) — неорганическое соединение, соль металла циркония и соляной кислоты с формулой  , бесцветные кристаллы, реагирует с водой.
, бесцветные кристаллы, реагирует с водой.

Окси́д га́фния(IV) — бинарное неорганическое соединение металла гафния и кислорода с формулой  бесцветные кристаллы или белый порошок, нерастворим в воде, из растворов солей выделяется в виде кристаллогидрата.
бесцветные кристаллы или белый порошок, нерастворим в воде, из растворов солей выделяется в виде кристаллогидрата.
Дигидроксид-оксид гафния (метагафниевая кислота) — неорганическое соединение, оксогидроксид гафния с формулой HfO(OH)2, белое аморфное вещество, не растворимое в воде.
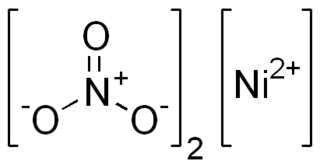
Нитра́т ни́келя(II) — неорганическое соединение, соль металла никеля и азотной кислоты с формулой Ni(NO3)2, светло-зелёные кристаллы, хорошо растворяется в воде. Образует кристаллогидраты.

Димер хлорида золота(III) — неорганическое соединение, соль металла золота и хлористоводородной кислоты, с формулой Au2Cl6. При нормальных условиях представляет собой блестящие призматические рубиново-красные кристаллы, хорошо растворимые в воде и органических растворителях. Легко восстанавливается до элементарного золота.
Теория Брёнстеда–Лоури — это кислотно-основная теория, которая была предложена независимо друг от друга учёными Брёнстедом Йоханнесом Николаусом и Лоури Томасом Мартином в 1923 году. Фундаментальная основа этой теории в том, что когда кислота и основание реагируют друг с другом, кислота образует сопряженное основание, а основание образует сопряженную кислоту с помощью обмена протоном (катионом водорода или H+). Эта теория является обобщением теории Аррениуса.

![{\displaystyle {\ce {H[BF4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4547785f23df3dc5976b84c6d2d2688233248db8)

![{\displaystyle {\ce {H[BF4],}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/336ddf22758a81e1b37393fe56c41081833ef8dc)
![{\displaystyle {\ce {H+[BF4]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7c4bb9bfd447e8626b4f9007352cca75776e109)


![{\displaystyle {\ce {[BF4]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4e5854298a3330174a384f09a532a637f2f29c2)
![{\displaystyle {\ce {H3O+[BF4]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e062061221a6369aadc72f68dcbbd903cffa67b)
![{\displaystyle {\ce {B2O3 + 8 HF -> 2 H[BF4] + 3 H2O;}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e90fe435d3403a0808d09ee3db6ce31c8b2274e)
![{\displaystyle {\ce {B(OH)3 + 4 HF -> H[BF4] + 3 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/441a8ce30f3bbf79e594da1d3eabb3c6569c29e6)
![{\displaystyle {\ce {4 BF3 + 3 H2O -> 3 H[BF4] + B(OH)3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba04216b5a95748b1f952edd5425031a39131526)
![{\displaystyle {\ce {H[BF4] + H2O -> [BF4]- + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/274eec2db9da3dce868a1e9ef7d913b2d9d32817)
![{\displaystyle {\ce {H[BF4] + H2O -> B(H2O)F3 + HF;}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88be8d5e9b9ece59bd4c0c9ba4bbcac1cac5decc)
![{\displaystyle {\ce {H[BF4] + 2 H2O -> H[B(OH)2F2] + 2 HF;}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e3f7d395ada1c0b50bf1fa8cfe5aa36d42daf827)
![{\displaystyle {\ce {H[BF4] + 3 H2O -> H[B(OH)3F] + 3 HF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/869c7065605f699868e83b36e29d1432b649fd64)
![{\displaystyle {\ce {H[BF4] ->[+130\ ^{{\ce {o}}}{\ce {C}}] BF3 ^ + HF ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/098df693de6643e2878922ae90911cc43b0b85e0)
![{\displaystyle {\ce {H[BF4] + NaOH -> Na[BF4] + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b211aa13daf0f5518942c6282cbfa842becccbd7)




















