Секвени́рование биополимеров — определение их аминокислотной или нуклеотидной последовательности. В результате секвенирования получают формальное описание первичной структуры линейной макромолекулы в виде последовательности мономеров в текстовом виде. Размеры секвенируемых участков ДНК обычно не превышают 100 пар нуклеотидов и 1000 пар нуклеотидов при секвенировании по Сенгеру. В результате секвенирования перекрывающихся участков ДНК получают последовательности участков генов, целых генов, тотальной мРНК или полных геномов организмов.
Полимера́зная цепна́я реа́кция (ПЦР) — метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты в биологическом материале (пробе).

ДНК-ма́ркеры (ДНК-маркёры), или молекулярно-генетические маркеры — полиморфный признак, выявляемый методами молекулярной биологии на уровне нуклеотидной последовательности ДНК для определённого гена или для любого другого участка хромосомы при сравнении генотипов различных особей, пород, сортов, линий.
Полимеразная цепная реакция в реальном времени — лабораторный метод, основанный на методе полимеразной цепной реакции, позволяющий определять не только присутствие целевой нуклеотидной последовательности в образце, но и измерять количество её копий. Количество амплифицированной ДНК измеряется после каждого цикла амплификации с помощью флуоресцентных меток: зондов или интеркаляторов. Оценка может быть количественной и относительной.
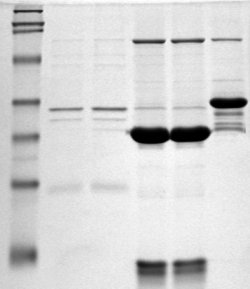
Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью. Данный способ фракционирования белков и пептидов широко применяют в современной молекулярной биологии, биохимии, генетике.
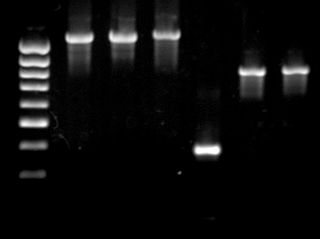
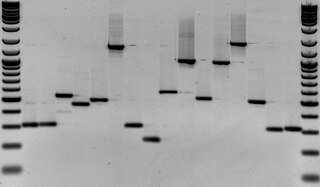
Электрофорез ДНК в агарозном геле — аналитический метод, применяемый для разделения фрагментов ДНК по длине. Основан на разной скорости движения фрагментов разной длины при движении в геле под действием внешнего электрического поля.
Электрофорез в полиакриламидном геле — метод молекулярной биологии и биохимии, используемый для разделения белков и нуклеиновых кислот, основанный на движении заряженных биологических макромолекул в постоянном электрическом поле. Разделение в полиакриламидном геле происходит за счёт различий заряда разделяемых молекул и отличий молекулярных масс, а также от конфигурации молекул. Различают т. н. неденатурирующий, или нативный ПААГ-электрофорез и денатурирующий ПААГ-электрофорез. В процессе денатурирующего ПААГ-электрофореза молекулы сохраняются в денатурированном состоянии за счёт наличия в геле хаотропных агентов в случае ПААГ-электрофореза нуклеиновых кислот и белков и наличия ионных и неионных детергентов.
- В случае электрофореза белков в полиакриламидном геле метод обычно используют в модификации Леммли (Laemmli)
- Также электрофорез в полиакриламидном геле применяют для разделения коротких фрагментов нуклеиновых кислот, например, ДНК-электрофорез, например, при секвенировании по Сэнгеру. Кроме этого, ПААГ-электрофорез применяют для визуализации в методах ПДРФ и ПЦР.
- Различают также т. н. диск-электрофорез, при котором в геле в процессе электрофоретического разделения белков на границе между концентрирующим и разделяющим гелями создаётся градиент pH, за счёт чего достигается лучшее разделение белковых молекул.

Микросателли́ты, или короткие тандемные (простые) повторы, — варьирующие участки (локусы) в ядерной ДНК и ДНК органелл, состоящие из тандемно повторяющихся мономеров длиной меньше 9 пар оснований и образующие поля менее 1 тысячи пар оснований. Являются широко распространёнными молекулярными маркерами в генетических и геномных исследованиях.
Капилля́рный электрофоре́з, известный также как капиллярный зональный электрофорез, используется для разделения ионов по заряду. В случае обычного электрофореза заряженные молекулы перемещаются в проводящей жидкости под действием электрического поля. В 1960-х годах была предложена методика капиллярного электрофореза для разделения молекул по заряду и размеру в тонком капилляре, заполненном электролитом.
Футпринтинг ДНК — метод поиска в структуре ДНК последовательностей связывания ДНК-связывающих белков. Данный метод используют для изучения взаимодействия белков с ДНК как in vitro, так и in vivo.

Трицин — органическое соединение, используемое для приготовления буферных растворов. Название «трицин» происходит от слов «трис» и «глицин». Молекула трицина представляет собой цвиттер-ионную аминокислоту, и имеет интервал буферных свойств pH 7.4-8.8.
Натрий-фосфатный буфер — буферный раствор, используемый в биологических исследованиях. Представляет собой водный раствор солей, содержащий хлорид натрия, гидрофосфат натрия, хлорид калия и дигидрофосфат калия. Осмолярность и концентрации ионов в растворе обычно соответствуют концентрациям в теле человека.

Трис (англ. Tris, THAM) — сокращённое название химического соединения трис(гидроксиметил)аминометана (HOCH2)3CNH2. Трис широко используется в биохимии и молекулярной биологии в качестве буферного раствора, например, в буферных системах TAE и TBE, для растворения нуклеиновых кислот. По химической структуре трис является первичным амином и имеет характерные для аминов свойства, например, конденсируется с альдегидами.
Количественный анализ нуклеиновых кислот — определение концентрации ДНК или РНК в смеси или чистом препарате. Реакции с участием нуклеиновых кислот часто требуют точных сведений о количестве и чистоте препарата. Для определения концентрации нуклеиновой кислоты в растворе используют спектрофотометрический метод и УФ-флюоресценцию, если нуклеиновая кислота содержит краситель.

Нозерн-блот — метод исследования экспрессии генов путём тестирования молекул РНК (мРНК) и их фрагментов в образцах.
Полони-секвенирование — технология секвенирования нового поколения (NGS) без электрофоретического разделения, позволяющая прочитывать миллионы коротких иммобилизованных последовательностей ДНК, значительно более дешевая по сравнению с секвенированием по Сэнгеру.

Среда LB — богатая среда для роста культур бактерий. Аббревиатура LB часто неверно расшифровывается как Luria broth, Lennox broth, или Среда Luria-Bertani. Согласно автору прописи среды, Джузеппе Бертани, сокращение LB означает англ. lysogeny broth — лизогенная среда. Состав среды LB впервые опубликован в 1951 году в статье Бертани по лизогении. В этой статье описано выделение фагов энтеробактерий P1, P2 и P3 в разработанной им среде для оптимального роста Shigella и образования бляшек фагов.
Буфер TE — широко используемый буферный раствор в биохимии и молекулярной биологии, применяемый для выделения и манипуляций с ДНК, кДНК и РНК. Название буфера является аббревиатурой от его компонентов буферного вещества Трис и ЭДТА, хелатирующего катионы металлов, например, Mg2+. Буфер ТЕ используют для растворения ДНК или РНК и предотвращения деградации нуклеиновой кислоты.
Электрофорез двумерный — процесс разделения сложных связей белков, в котором сочетаются электрофорез белков и изоэлектрическое фокусирование. Метод позволяет изучать структуры, возникающие в сверхспирализованной молекуле кольцевой ДНК.
Гелика́з-зави́симая амплифика́ция, также гелика́за-зави́симая изотерми́ческая амплифика́ция, — это метод амплификации ДНК in vitro, который осуществляется при постоянной температуре.








