
Жи́дкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями.

Адге́зия в физике — сцепление поверхностей разнородных твёрдых и/или жидких тел. Адгезия обусловлена межмолекулярными взаимодействиями в поверхностном слое и характеризуется удельной работой, необходимой для разделения поверхностей. В некоторых случаях адгезия может оказаться сильнее, чем когезия, то есть сцепление внутри однородного материала, в таких случаях при приложении разрывающего усилия происходит когезионный разрыв, то есть разрыв в объёме менее прочного из соприкасающихся материалов.
Адсорбция — самопроизвольный процесс увеличения концентрации растворённого вещества у поверхности раздела двух фаз вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция.

Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.

Критическая точка фазового равновесия — точка на диаграмме состояния веществ, соответствующая критическому состоянию, то есть конечная точка кривой сосуществования фаз, в котором две фазы, находящиеся в термодинамическом равновесии, становятся тождественными по своим свойствам. В частности, с приближением к критическому состоянию различия в плотности, составе и других свойствах сосуществующих фаз, а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются, а в критической точке равны нулю. В окрестности критической точки наблюдаются критические явления.
Моносло́й — единичный, плотно упакованный слой атомов либо молекул.

Пе́на — дисперсная система с газовой дисперсной фазой и жидкой или твёрдой дисперсионной средой.
Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
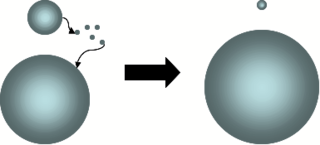
Переконденсация или Оствальдовское созревание — процесс конденсации пересыщенной фазы вещества, наблюдаемый в жидких золях или твёрдых коллоидных растворах на поздних временах развития, когда закончен этап нуклеации, а рост крупных зёрен новой фазы происходит за счёт более мелких в условиях «подавления без поедания», то есть растворения капель без их слипания. Явление впервые описано Оствальдом. Переконденсация может проходить в двух режимах: под управлением поглощающей способности поверхности капель, когда длина свободного пробега молекулы много больше радиуса сферического зерна, а в другом случае под управлением диффузии в паре. Последняя излагается в последней главе последнего тома известного курса теоретической физики Ландау, Лифшица, Питаевского. Когда данный феномен происходит в твёрдых микродисперсных растворах или осадках, употребляют термин Оствальдовская перекристаллизация.

Пар — жи́дкость — криста́лл или ПЖК ) — механизм роста одномерных структур, таких как нановискеры в процессе химического осаждения из газовой фазы. Рост кристалла вследствие осаждения из газовой фазы обычно протекает очень медленно. Однако возможно введение на поверхность капель катализатора, способного адсорбировать вещество из газа до состояния пересыщенного расплава, из которого и будет происходить его кристаллизация на подложку. Таким образом, физические параметры нановискеров могут управляться размером и свойствами жидкого сплава, из которого состоят капли.

Неустойчивость Рэлея — Тейлора — самопроизвольное нарастание возмущений давления, плотности и скорости в газообразных и жидких средах с неоднородной плотностью, находящихся в гравитационном поле либо движущихся с ускорением.
Работа образования капли — работа, необходимая для образования капли, т. е. зародыша стабильной фазы, в исходной метастабильной фазе.

Мени́ск — искривление свободной поверхности жидкости вследствие её соприкосновения с поверхностью твёрдого тела или (реже) другой жидкости. Образуется в каналах и порах, около стенок сосудов, у края тел, помещённых в жидкость.
Поверхность раздела фаз — граничная поверхность между любыми двумя контактирующими фазами термодинамической системы. Например, в трёхфазной системе лёд — вода — воздух существуют три поверхности раздела, вне зависимости от того, сколько кусков льда имеется в системе.
Уравнение Дюпре — Юнга — уравнение, характеризующее связь между работой адгезии и краевым углом смачивания.
Поверхностная энергия, также свободная поверхностная энергия, поверхностная энергия Гиббса — термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз. Другое определение поверхностной энергии — это потенциальная энергия, которая сосредоточена на межфазной поверхности, необходимая для образования единицы площади поверхности. Является избыточной по сравнению с энергией в объёме, то есть не равной нулю. Единица измерения в системе СИ — Дж/м2.

Краевой угол смачивания, также угол смачивания, угол контакта — угол, который образуется между касательной, проведённой к поверхности фазы жидкость-газ и твёрдой поверхностью с вершиной, располагающейся в точке контакта трёх фаз, и условно измеряемый всегда внутрь жидкой фазы. Обозначается греческой буквой тета — θ.
Растекание жидкости — физический процесс распространения жидкости по поверхности твёрдого тела или другой жидкости, посредством полного смачивания. Растекание жидкости обусловлено различными факторами, основными из которых являются адгезия, вязкость и смачивание. При растекании жидкости краевой угол смачивания θ равен нулю, поэтому количественной характеристикой растекания является коэффициент растекания по Гаркинсу — f.
Уравнение Кельвина, также известное как уравнение капиллярной конденсации Томсона — уравнение в термодинамике, характеризующее изменение давления p насыщенного пара жидкости или растворимости c твёрдых тел. Выведено Уильямом Томсоном, лордом Кельвином, в 1871 году, но в современном виде было представлено только в 1885 году Германом фон Гельмгольцем.












