Дезоксирибонуклеи́новая кислота́ (ДНК) — макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования организмов. Молекула ДНК хранит биологическую информацию в виде генетического кода, состоящего из последовательности нуклеотидов. ДНК содержит информацию о структуре различных видов РНК и белков.

Метаболи́зм, или обме́н веще́ств, — это химические реакции, поддерживающие жизнь в живом организме. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды.

Хромосо́мы — нуклеопротеидные структуры в ядре эукариотической клетки, в которых сосредоточена бо́льшая часть наследственной информации и которые предназначены для её хранения, реализации и передачи. Хромосомы чётко различимы в световом микроскопе только в период митотического или мейотического деления клетки. Набор всех хромосом клетки, называемый кариотипом, является видоспецифичным признаком, для которого характерен относительно низкий уровень индивидуальной изменчивости.

Аденозинтрифосфа́т (ион), Аденозинтрифосфорная кислота, АТФ — нуклеозидтрифосфат, играющий основную роль в обмене энергии в клетках живых организмов. Это универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.

Митохо́ндрия — двумембранная сферическая или эллипсоидная органелла диаметром обычно около 1 микрометра. Характерна для большинства эукариотических клеток, как автотрофов, так и гетеротрофов. Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза АТФ и термогенеза. Эти три процесса осуществляются за счёт движения электронов по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют. В специализированных клетках органов животных содержатся сотни и даже тысячи митохондрий.

Болезнь Гю́нтера — эритропоэтическая порфирия. Названа в честь описавшего болезнь в 1911 году немецкого врача Ганса Гюнтера. Встречается крайне редко: менее 1 случая на 1,000,000 новорожденных.

Липопротеинлипаза — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности ). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе.

Окисли́тельное фосфорили́рование — метаболический путь, при котором энергия, образовавшаяся при окислении питательных веществ, запасается в митохондриях клеток в виде АТФ. Хотя различные формы жизни на Земле используют разные питательные вещества, АТФ является универсальным соединением, в котором запасается энергия, необходимая для других метаболических процессов. Почти все аэробные организмы осуществляют окислительное фосфорилирование. Вероятно, широкому распространению этого метаболического пути способствовала его высокая энергетическая эффективность по сравнению с анаэробным брожением.
Кардиолипин — фосфолипид, который является важным компонентом внутренней мембраны митохондрий, липидный состав которой включает около 20 % кардиолипина. Кардиолипин во внутренней мембране митохондрий клеток млекопитающих и растительных клеток необходим для функционирования многочисленных ферментов, участвующих в энергетическом обмене. Кардиолипин также встречается в мембранах бактерий.
Протеинкина́зы — подкласс ферментов киназ (фосфотрансфераз). Протеинкиназы модифицируют другие белки путём фосфорилирования остатков аминокислот, имеющих гидроксильные группы или гетероциклической аминогруппы гистидина.

δ-Аминолевулиновая кислота — органическая кислота, первичный компонент синтеза тетрапирролов: порфиринов и корринов у животных и хлорофилла у растений.
Сигнальные молекулы газообразных веществ — малые молекулы таких химических соединений, которые при температуре тела и нормальном атмосферном давлении находились бы в газообразном агрегатном состоянии, будучи выделены в свободном виде. Сигнальные молекулы газообразных веществ выполняют в организме, ткани или клетке сигнальные функции, вызывая своим воздействием физиологические или биохимические изменения и/или участвуя в регуляции и модуляции физиологических и биохимических процессов. Некоторые из сигнальных молекул газообразных веществ (СМГВ) образуются эндогенно, то есть в самом организме, некоторые другие, как, например, кислород, поступают извне.

Митохондриа́льный ма́трикс или просто ма́трикс — ограниченное внутренней мембраной пространство, расположенное внутри митохондрий. Слово «матрикс» происходит из того, что эта среда является намного более вязкой по сравнению с более водянистой цитоплазмой. В состав матрикса входит множество веществ, включая ферменты, митохондриальную ДНК (кольцевая), рибосомы, малые органические молекулы, нуклеотидные коферменты и неорганические ионы. Ферменты матрикса содействуют реакциям биохимических процессов, в ходе которых синтезируется АТФ, таких как цикл трикарбоновых кислот, окислительное фосфорилирование, окисление пирувата и бета-окисление жирных кислот.

Бета-цепь 3 Na+/K+-АТФ-азы (ATP1B3) (англ. Sodium/potassium-transporting ATPase subunit beta-3; CD298) — белок, некаталитический компонент фермента, продукт гена человека ATP1B3. Бета-цепь Na+/K+-АТФ-аза, принадлежит к семейству бета-цепей Na+/K+-АТФ-аз и Н+/К+-АТФаз.
Альфа-токсин Clostridium perfringens — это токсин, продуцируемый бактерией Clostridium perfringens, и он отвечает за газовую гангрену и мионекроз в инфицированных тканях. Токсин также обладает гемолитической активностью.
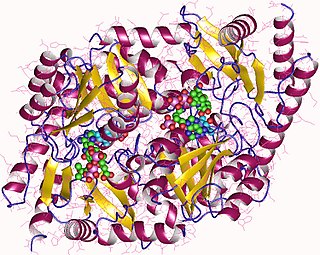
АЛК-синтаза, также синтаза аминолевулиновой кислоты (англ. ALA synthase, ALAS) — фермент (КФ 2.3.1.37), из семейства ацилтрансферазы (класс трансфераз), встречается у нерастительных организмов (животных и α-протеобактерий) и катализирует реакцию синтеза δ-аминолевулиновой кислоты (дАЛК или АЛК) из глицина и сукцинил-КоА, путём их конденсации:
- сукцинил-КоА + глицин
 δ-аминолевулиновая кислота + КоА + CO2.
δ-аминолевулиновая кислота + КоА + CO2.

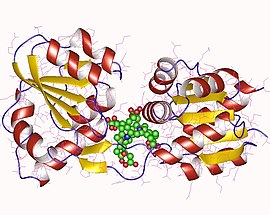
Феррохелатаза, также протопорфирин феррохелатаза или протогем ферро-лиаза (протопорфиринобразующая) — фермент (КФ 4.98.1.1 ) из класса лиаз, который катализирует последнюю (8-ю) реакцию биосинтеза гема — превращение молекул протопорфирина IX в гем Б. У человека фермент кодируется геном FECH, локализованный на коротком плече (p-плече) 18-й хромосомы. Реакция, катализируемая данным ферментом:
- протогем (гем Б) + 2H+ = протопорфирин IX + Fe+2.

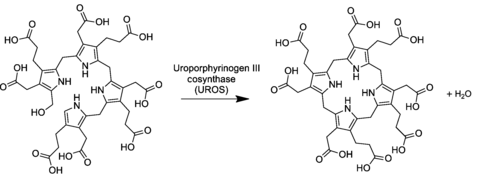
Биосинтез гема — метаболический многоступенчатый процесс образования молекул гема из его предшественников. Гем представляет собой плоский железосодержащий макроциклический комплекс, основу которого составляет четыре пиррольных кольца (тетрапиррол), объединённые между собой метениловыми мостиками (=СH-) и координированные двухвалентным железом (Fe2+). Гем имеет несколько типов, они отличаются как структурно, так и функционально. Но наиболее распространённым типом гема, является — гем Б.

Уропорфириноген III декарбоксилаза, также уропорфириноген декарбоксилаза (сокр. УПГ-III-декарбоксилаза) — фермент (КФ 4.1.1.37) из семейства декарбоксилазы (класс лиазы), катализирует реакцию декарбоксилирования молекул уропорфириногена III в копропорфириноген III. Реакция имеет следующий вид:
- уропорфириноген III
 копропорфириноген III + 4CO2.
копропорфириноген III + 4CO2.