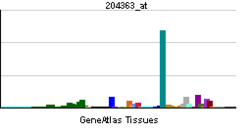
Систе́ма комплеме́нта — комплекс защитных белков, постоянно присутствующих в крови. Это каскадная система протеолитических ферментов, предназначенная для гуморальной защиты организма от действия чужеродных агентов, она участвует в реализации иммунного ответа организма. Является важным компонентом как врождённого, так и приобретённого иммунитета. Выделяют три основных пути активации системы комплемента: классический, альтернативный и лектиновый. Для запуска классического пути комплемента необходима опсонизация чужеродной клетки антителами, а альтернативный и лектиновый пути могут активироваться в отсутствие антител. Поздние стадии у всех трёх путей активации системы комплемента одинаковы и включают образование мембраноатакующего комплекса, который нарушает целостность мембраны клетки-патогена и приводит к её гибели.

Имму́нная систе́ма — система биологических структур и процессов организма, обеспечивающая его защиту от инфекций, токсинов и злокачественных клеток. Для правильной работы иммунной системы необходимо, чтобы она умела распознавать широкий спектр патогенов — от вирусов до многоклеточных паразитов — и отличать их от собственных здоровых тканей организма. У многих видов имеются две подсистемы: врождённая иммунная система и приобретённая (адаптивная) иммунная система. Обе подсистемы используют как гуморальные механизмы, так и клеточные механизмы. К числу древнейших механизмов иммунной системы животных относят фагоцитоз, систему комплемента и антимикробные пептиды. Адаптивная иммунная система в ходе эволюции появилась у челюстноротых позвоночных животных. Один из важнейших механизмов адаптивной иммунной системы — иммунологическая память, благодаря которой организм развивает более сильный иммунный ответ на патоген после первой встречи с ним. Основу вакцинации составляет именно иммунологическая память.

Лейкоци́ты — неоднородная группа различных по внешнему виду и функциям клеток крови человека и животных, выделенная по признакам наличия ядра и отсутствия самостоятельной окраски. Образуются в красном костном мозге, обнаруживаются во всём организме животного. Продолжительность жизни лейкоцита колеблется от нескольких часов до нескольких лет. Главная функция лейкоцитов — защита организма от патогенов и удаление продуктов разрушения тканей.
Эозинофи́лы — разновидность лейкоцитов, основная функция которых заключается в борьбе с многоклеточными паразитами. Зрелые эозинофилы человека имеют ядро, разделённое на две части (двудольное), и эозинофильные гранулы, содержащие белки с цитотоксическими свойствами. Молекулярными маркерами эозинофилов являются белки CD9 и CD35. У здорового человека эозинофилы составляют от 0,5 % до 5 % от общего числа лейкоцитов.

Фагоци́ты — клетки иммунной системы, которые защищают организм путём поглощения (фагоцитоза) вредных чужеродных частиц, а также мёртвых или погибающих клеток. Они важны для борьбы с инфекцией и постинфекционного иммунитета. Фагоцитоз важен для всего животного мира и высоко развит у позвоночных. Роль фагоцитов в защите от бактерий была впервые открыта И. И. Мечниковым в 1882 году, когда он изучал личинок морских звёзд. Мечников был удостоен в 1908 году Нобелевской премии по физиологии за создание клеточной теории иммунитета. Фагоциты присутствуют в организмах многих видов; некоторые амёбы по многим деталям поведения похожи на макрофаги, что указывает на то, что фагоциты появились на ранних этапах эволюции.
Свёртывание крови (гемокоагуляция) — это важнейший этап работы системы гемостаза, отвечающий за остановку кровопотери при повреждении сосудистой системы организма. Совокупность взаимодействующих между собой факторов свёртывания крови образует систему свёртывания крови.

Ту́чные кле́тки — тканевые клетки миелоидного ряда, содержащие в цитоплазме базофильные гранулы с гистамином и гепарином. В отличие от базофилов, также содержащих базофильные гранулы, тучные клетки в норме никогда не выходят в кровоток. Тучные клетки участвуют в развитии воспаления, реакций гиперчувствительности первого (немедленного) типа, защите организма от многоклеточных паразитов и других патогенов, формировании гематоэнцефалического барьера и других процессах. Тучные клетки лежат в основе развития аллергии и анафилаксии.
Макрофа́ги — клетки в организме животных, способные к активному захвату и перевариванию бактерий, остатков погибших клеток и других чужеродных или токсичных для организма частиц. Термин «макрофаги» введён Мечниковым. Устаревшие, вышедшие из употребления синонимы: гистиоцит-макрофаг, гистофагоцит, макрофагоцит, мегалофаг-пожиратель.
-селектин — гликопротеин, находящийся на клеточной поверхности, относится к классу молекул клеточной адгезии; рецептор к некоторым углеводным лигандам лейкоцитов крови. Вырабатывается клетками эндотелия в случае воспалительного повреждения ткани, например инфицировании, и способствует рекрутированию нейтрофилов из циркулирующей крови к месту повреждения. Наиболее распространённый и более изученный из 3 селектинов.

Фактор фон Виллебранда — гликопротеин плазмы крови, играющий важную роль в гемостазе, а именно обеспечивающий прикрепление тромбоцитов к участку повреждённого сосуда. Кодируется геном VWF, расположенным на 12-й хромосоме. Нехватка или дефекты фактора фон Виллебранда приводят к развитию болезни Виллебранда и многих других заболеваний, в числе которых тромботическая пурпура, синдром Гейде и гемолитико-уремический синдром.

Факторы свёртывания крови — группа веществ, содержащихся в плазме крови и тромбоцитах и обеспечивающих свёртывание крови. Большинство факторов свёртывания — белки. К факторам свёртывания относятся также ионы кальция и некоторые низкомолекулярные органические вещества. В норме белковые факторы свёртывания крови находятся в плазме в неактивном состоянии. Если фактор активируется, то к его обозначению добавляют букву «а». Международный комитет по гемостазу и тромбозу присвоил арабскую нумерацию тромбоцитарным и римскую — плазменным факторам. Всего выделяют 13 плазменных факторов и 22 тромбоцитарных.
Антитромбин — основной плазменный белковый фактор, синтезируется, в основном, в сосудистом эндотелии и клетках печени. Оказывает основное угнетающее (антикоагуляционное) действие на процессы свёртывания крови.
Протромбиновое время (ПТВ) и его производные протромбиновый индекс (ПТИ) и международное нормализованное отношение (МНО) — лабораторные показатели, определяемые для оценки внешнего пути свёртывания крови. Используются при оценке системы гемостаза в целом, эффективности терапии варфарином, степени нарушения печеночной функции, степени насыщения витамином К. ПТВ позволяет оценить активность факторов свертывания I, II, V, VII и X. Зачастую определяется вместе с показателем активированное частичное тромбопластиновое время (АЧТВ), которое оценивает внутренний путь свертывания крови.

Фактор свёртывания крови IX — белок α—глобулин, профермент (протеаза). Играет важную роль в процессах свёртывания крови.

Фактор свёртывания крови VIII — белок β-глобулин. Образует комплекс с фактором Виллебранда, который синтезируется в клетках эндотелия и печени. Играет важную роль в процессах свёртывания крови.

Протромбина́за — сложный комплекс, который состоит из активированных X и V факторов свёртывания, формирующийся на фосфолипидной поверхности мембран тромбоцитов, в присутствии ионов кальция. Катализирует превращение II фактора из неактивной формы (протромбин) в активную (тромбин).
Наруше́ния кровообраще́ния — типовые патологические процессы, обусловленные изменением объёма крови в сосудистом русле, её реологических свойств или выходом крови за пределы сосудов.
Терапевтический ангиогенез — тактика стимуляции образования новых кровеносных сосудов для лечения или профилактики патологических состояний, характеризующихся снижением этой функции.
Тест тромбодинамики – это глобальный тест свертывающей системы крови. С одинаково высокой чувствительностью позволяет выявлять нарушения системы свертывания крови – как гипо-, так и гиперкоагуляцию. Подходит для ранней диагностики склонности к тромбообразованию. Метод разработан в лаборатории физической биохимии ГНЦ РАМН под руководством доктора биологических наук Фазли Атауллаханова. Диагностическое оборудование на базе данного метода выпускает компания "ГемаКор".
Некропто́з — программируемая некротическая гибель клетки, сопровождаемая активацией взаимодействующей с рецептором протеинкиназы-3. На молекулярном уровне при некроптозе происходит строго регулируемая сборка внутриклеточного комплекса, известного как некросома, запускаемая рецепторами смерти, поверхностными Toll-подобными рецепторами, а также механизмами, распознающими присутствие в цитоплазме вирусных РНК. Для некроптоза, индуцируемого фактором некроза опухоли (TNF), необходима дальнейшая активация RIPK1 (RIP1) и RIPK3. Блокирование этих киназ некростатинами, например, некростатином 1, ингибирующим RIPK1, делает некроптоз невозможным. В отличие от апоптоза, вызываемого активацией каспазы 8, некроптоз может протекать лишь при инактивации этого фермента. При некроптозе также происходит образование активных форм кислорода в митохондриях, однако, в отличие от апоптоза, не происходит фрагментация ДНК. Кроме того, в отличие от апоптоза, некроптоз сопровождается сильным иммунным ответом: погибающая клетка высвобождает молекулярные фрагменты, ассоциированные с повреждениями, которые активируют иммунитет. Некроптоз может запускаться в тех случаях, когда апоптоз по тем или иным причинам невозможен. В отличие от молекулярных путей апоптоза, изучаемых уже много лет, молекулярные основы некроптоза в настоящее время мало изучены.