Фосфорноватистая кислота
| Фосфорноватистая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | фосфорноватистая кислота | ||
| Традиционные названия | фосфиновая кислота, гипофосфористая кислота | ||
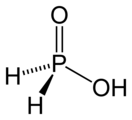
| Хим. формула | H(PH2O2) | ||
| Физические свойства | |||
| Состояние | твердое | ||
| Молярная масса | 66.00 г/моль | ||
| Плотность | 1.274 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 26.5 °C | ||
| • кипения | 106 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 1.2 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Классификация | |||
| Рег. номер CAS | 6303-21-5 | ||
| PubChem | 4124402 | ||
| Рег. номер EINECS | 228-601-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 29031 | ||
| ChemSpider | 10449263 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фосфорнова́тистая кислота (гипофосфористая кислота, фосфи́новая кислота) — слабая одноосновная кислота. Бесцветное твердое вещество, растворимое в воде, спиртах и диоксане.
Фосфорноватистая кислота H(PН2O2) существует в равновесии со своим таутомером HP(OH)2.
Соли фосфорноватистой кислоты — гипофосфиты, или фосфинаты — средние соли.
Получение
Фосфорноватистую кислоту получают в две стадии. На первой стадии белый фосфор обрабатывается раствором щелочи:
И затем выделяют кислоту, обрабатывая её соль более сильной кислотой (серной):
Гипофосфиты
Соли фосфорноватистой кислоты называют фосфинатами или гипофосфитами. Они хорошо растворимы в воде. Примеры фосфинатов:
Свойства
Гипофосфиты и фосфорноватистая кислота являются энергичными восстановителями, особенно в кислой среде. Наибольшее практическое значение имеет их способность восстанавливать растворенные соли некоторых металлов (Ni, Cu и др.) до свободного металла. Сама кислота H(PН2O2) при этом окисляется до фосфористой кислоты H2(РНО3):
С помощью таких реакций можно получать прочные металлические покрытия. Методом химического металлирования можно покрывать неэлектропроводные вещества, например стекло, керамику, пластмассы, для которых нельзя применять электрохимические методы.
Соли фосфорноватистой кислоты также используются для приготовления лекарственных препаратов.
См. также
Литература
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
- Коттон Ф., Уилкинсон Дж. Современная неорганическая химия ч. 2. — М.: Мир, 1969.