
Ио́д — химический элемент 17-й группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53.

Иодиды — бинарные соединения иода с менее электроотрицательными элементами. Иодиды металлов могут рассматриваться как соли иодоводородной кислоты HI.

Фтори́д ио́да(VII) (гептафтори́д ио́да, семифто́ристый ио́д), IF7 — бесцветный чрезвычайно ядовитый тяжёлый газ (при 20 °C) с резким неприятным запахом, высший фторид иода, в котором атом иода проявляет степень окисления +7. Тяжелее воздуха почти в 9 раз.
Фторид иода(V) (пентафторид иода) IF5 — соединение иода с фтором, представляющее собой жёлтую жидкость. Химически чрезвычайно активен и агрессивен к большинству материалов.

Фтори́д ио́да(I) — бинарное соединение иода с фтором, имеющее формулу IF и представляющее собой при температуре около 0 °C жидкость жёлтого цвета с сильным раздражающим запахом, похожим на запах трифторида иода.
Галогени́ды, галоиды — соединения галогенов с другими химическими элементами или радикалами. При этом галоген, входящий в соединение, должен быть более электроотрицательным, чем другой элемент соединения, то есть проявлять степень окисления, равную -1; так, оксид брома не является галогенидом.
Фторид урана — химическое соединение урана с фтором:
- Фторид урана(III)
- Фторид урана(IV)
- Фторид урана(V)
- Фторид урана(VI)
- Нонафторид диурана U2F9
- Гептадекафторид тетраурана U4F17

Иоди́д бери́ллия — химическое соединение с формулой BeI2. Иодид бериллия представляет собой бесцветные игольчатые кристаллы. В присутствии влаги или при растворении в воде соединение быстро гидролизирует, с выделением газообразного йодоводорода. Относится к иодидам, то есть солям йодоводородной кислоты HI.
Связь Be-I в соединении практически ковалентная. В парах, вблизи температуры плавления, молекулы иодида бериллия преимущественно димерны (Be2I4).
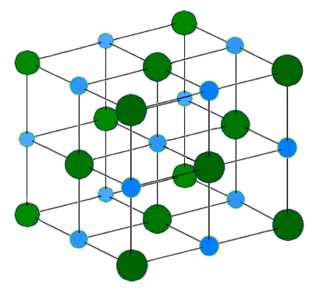
Ио́нные криста́ллы представляют собой кристаллы, состоящие из ионов, связанных между собой электростатическим притяжением. Примерами таких кристаллов являются галогениды щелочных металлов, в том числе фторид калия, хлорид калия, бромид калия, иодид калия, фторид натрия и другие комбинации ионов натрия, цезия, рубидия и лития с ионами фтора, брома, хлора и иода.

Пентаокси́д диио́да (оксид иода(V), иодноватый ангидрид) — бинарное неорганическое соединение иода и кислорода с формулой I2O5, бесцветные кристаллы, темнеют на свету из-за разложения, очень гигроскопичные, хорошо растворимые в воде.

Фторид технеция(VI) — неорганическое соединение, соль металла технеция и плавиковой кислоты с формулой TcF6, ярко-жёлтые кристаллы, реагирует с водой.

Фторид рутения(V) — неорганическое соединение, соль металла рутения и плавиковой кислоты с формулой RuF5, тёмно-зелёные кристаллы, реагирует с водой, разъедает стекло.
Фторид-триоксид иода — неорганическое соединение, оксосоль иода и плавиковой кислоты с формулой IO3F, бесцветные кристаллы.
Фтори́д-диокси́д ио́да — неорганическое соединение, оксосоль иода и плавиковой кислоты с формулой IO2F, бесцветные кристаллы.
Фторид нептуния(V) — бинарное неорганическое соединение, соль нептуния и плавиковой кислоты с формулой NpF5, светло-голубые кристаллы.

Фторид осмия(V) — неорганическое соединение, соль металла осмия и плавиковой кислоты состава OsF5, сине-зелёные кристаллы, гидролизуется водой.
Фторид рутения(III) — неорганическое соединение, соль металла рутения и плавиковой кислоты с формулой RuF3, тёмно-коричневые кристаллы, не растворяется в воде.

Окси́ды ио́да — бинарные химические соединения иода и кислорода. Лишь некоторые из теоретически возможных оксидов иода были выделены в чистом виде. Ряд соединений, вероятно являющихся оксидами иода, был обнаружен в атмосфере; эти соединения считаются важным фактором в обмене иодом между океаном и атмосферой.
Фторид технеция(V) — неорганическое соединение, соль технеция и плавиковой кислоты с формулой TcF5. Представляет собой жёлтые кристаллы, реагирующие с водой.

Дибромдифтормета́н — химическое соединение из группы галогенированных углеводородов, полностью замещённый галогеналкан, производное метана, имеет формулу CBr2F2. При нормальных условиях — летучая бесцветная жидкость.











