Хлорид хрома(II)
| Дихлорид хрома | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | хлорид хрома(II) |
| Хим. формула | CrCl2 |
| Физические свойства | |
| Молярная масса | 122,902 г/моль |
| Плотность | 2,9 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 824 °C |
| • кипения | 1120 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | растворим |
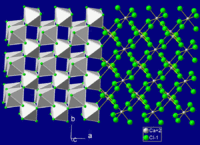
| Структура | |
| Координационная геометрия | октаэдрическая, 6-координированная |
| Кристаллическая структура | орторомбическая, oP6 |
| Классификация | |
| Рег. номер CAS | 10049-05-5 |
| PubChem | 24871 |
| Рег. номер EINECS | 233-163-3 |
| SMILES | |
| InChI | |
| RTECS | GB5250000 |
| ChemSpider | 23252 |
| Безопасность | |
| ЛД50 | (орально, крысы) 1870 мг/кг |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлори́д хро́ма(II) CrCl2 — белые, чрезвычайно гигроскопичные кристаллы, растворимые в воде. Нерастворим в диэтиловом эфире, малорастворим в спирте.
Свойства
Водные растворы имеют голубой цвет. Образует комплексы с аммиаком, гидразином, дипиридилом и другими соединениями.
Получение
Получают восстановлением CrCl3 водородом при 700 °C:
взаимодействием CrCl3 с алюмогидридом лития:
взаимодействием атомарного водорода с CrCl3:
или взаимодействием соляной кислоты с хромом в инертной атмосфере (в присутствии воздуха образуется CrCl3):
Химические свойства
CrCl2 — сильный восстановитель. Как и многие другое соединения Cr(II), раствор CrCl2 на воздухе легко окисляется:
Взаимодействием солей Cr(II) со щелочами в инертной атмосфере можно получить жёлтый осадок гидроксида хрома(II) Cr(OH)2:
Применение
Применяют в хроматометрии, как катализатор при синтезе многих органических соединений.
Физиологическое действие
CrCl2 — раздражающее вещество.
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.


![{\displaystyle {\mathsf {4CrCl_{3}+Li[AlH_{4}]\rightarrow 4CrCl_{2}+LiCl+AlCl_{3}+2H_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/237f14d4e7a3f0b436e71aa616d685a65e0c498d)
![{\displaystyle {\mathsf {CrCl_{3}+[H]{\xrightarrow[{}]{Zn,HCl}}CrCl_{2}+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f5c294220b8d3c77b62d25495f0b910521e48ecc)















